Aktywacja dopełniacza przez składniki z mikrozaskórnika zostaje dodatkowo zwiększona przez przeciwciała przeciwko Propionibacterium acnes. Zatem także inicjacja odpowiedzi humoralnej nasila w trądziku reakcję zapalną. Stąd sugestia, że u pacjentów z trądzikiem istnieje genetycznie uwarunkowana nadwrażliwość na Propionibacterium acnes.
Mieszki włosowe chorych na trądzik charakteryzują się nasiloną, w porównaniu z osobami zdrowymi, reaktywnością na czynniki takie jak: niektóre kosmetyki, kortykosteroidy, izoniazyd, jodek potasu, wyrażające się powstawaniem mikrozaskórników i zaskórników. Przyczyna tego zjawiska jest nieznana.[10]
Peptydy antybakteryjne, stres oksydacyjny
Najnowsze badania dowodzą, że zidentyfikowane peptydy antybakteryjne HNP1-3 wykazują aktywność w neutrofilach zmian zapalnych u pacjentów z trądzikiem, natomiast nie występują w skórze zdrowej u tych chorych ani w skórze zdrowych ochotników. Białka te należą do grupy α-defensyn. Podobną aktywność wykazują także β-defensyny (hBD1-4). Na stałe w keratynocytach aktywność wykazuje hBD1, natomiast hBD2-4 produkowane są przez keratynocyty pod wpływem IL-1, TNF i lipopolisacharydów (LPS).
Inne doniesienia określają rolę Fox01 w patogenezie trądziku. Uważa się, że deficyt jądrowego czynnika transkrypcyjnego Fox01 jest kluczowy dla etiologii acne. Czynnik Fox01 jest supresorem wielu receptorów, m.in. receptora androgenów. Bierze udział w biosyntezie lipidów i cytokin prozapalnych. Nasilenie czynników wzrostu w okresie dojrzewania oraz tzw. zachodni styl życia stymulują eksport Fox01 poza jądro komórkowe do cytoplazmy przez aktywację ścieżki fosfo-foinozytydo-3-kinazy (PIK3). Przez ten mechanizm geny i receptory jądrowe powodują wzrost poziomu receptorów dla androgenów (blokowanie supresji), wzrost poziomu komórek androgenozależnych, nasilenie lipogenezy i wzrost produkcji TLR2-zależnych cytokin prozapalnych. Retinoidy, antybiotyki i odpowiednia dieta mogą spowodować wzrost jądrowego Fox01 i normalizować powyższe procesy, działając przeciwtrądzikowo.[11]
Zwrócono również uwagę na rolę stresu oksydacyjnego w etiologii trądziku. W cytowanym badaniu u pacjentów oznaczano poziom katalazy (CAT), dysmutazy nadtlenkowej (SOD), oksydazy ksantynowej (XO), tlenku azotu (NO) i malondialdehydu (MDA) we krwi żylnej metodą spektrofotometryczną. Poziomy MDA i XO były znamiennie wyższe w grupie osób z trądzikiem. Poziomy SOD i CAT były natomiast znamiennie niższe niż w grupie kontrolnej. Poziom NO był wyższy w grupie acne, aczkolwiek nie było tu znamienności statystycznej. Konkluzją z badania była sugestia roli uszkodzenia oksydacyjnego tkanek jako jednego z czynników etiologicznych trądziku.[12,13]
Zaburzenia hormonalne
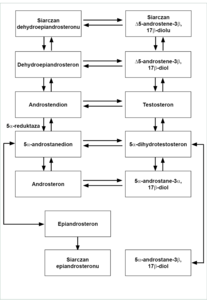
Aktywność aparatu mieszkowo-łojowego regulowana jest przez hormony płciowe. Keratynocyty mieszków włosowych i sebocyty są celem dla androgenów na drodze pośredniej i bezpośredniej. Androgeny stymulują proliferację keratynocytów, wielkość gruczołów łojowych oraz wydzielanie łoju. Oprócz endogennych androgenów zmiany trądzikowe mogą wywoływać także lipidy hormonopodobne, androgeny z diety oraz neuropeptydy (ryc. 2).
Proces pokwitania charakteryzuje się zwiększeniem uwalniania gonadotropin przez przedni płat przysadki mózgowej, co pobudza produkcję estrogenów i androgenów. Gruczoły łojowe mają na powierzchni komórek receptory dla androgenów. U kobiet źródłem tych hormonów są: kora nadnerczy i jajniki, u mężczyzn - kora nadnerczy i jądra. W etiopatogenezie trądziku rolę odgrywa przede wszystkim pochodna testosteronu - 5α-dihydrotestosteron (DHT), który powstaje z testosteronu pod wpływem enzymu - 5α-reduktazy. U kobiet głównym prekursorem 5α-dihydrotestosteronu jest androstendion, który może być przekształcany za pomocą 5α-reduktazy w 5α-androstanedion, stanowiący prekursor DHT lub za pomocą 17β-dehydrogenazy hydroksysteroidowej w testosteron, który z kolei tworzy DHT pod wpływem 5α-reduktazy (ryc. 2). Żywność o wysokim indeksie glikemicznym oraz mleko podwyższają poziom tkankowy 5α-dihydrotestosteronu, stąd możliwy wpływ tej grupy pokarmów na zaostrzenie zmian trądzikowych.
Sebocyty mają również zdolność produkcji androgenów z cholesterolu poprzez enzymy układu cytochromu P-450. W metabolizmie lipidów w obrębie sebocytów rolę odgrywają także receptory aktywowane przez proliferatory peroksysomów (PPAR). Wydzielanie androgenów pobudza dodatkowo ekspresję PPAR, co wpływa na różnicowanie komórek gruczołów łojowych.
Rola poziomów androgenów w etiologii acne dzieli badaczy. Niektórzy autorzy potwierdzili znamiennie wyższe stężenie androgenów w surowicy u kobiet z trądzikiem w porównaniu ze zdrowymi. Tego rodzaju zjawiska nie zaobserwowano u mężczyzn. Wykazano również zwiększenie aktywności 5α-reduktazy i 17β-dehydrogenazy hydroksysteroidowej w naskórku i mieszkach włosowych u osób chorych na trądzik w porównaniu z populacją zdrową. Natomiast inni uważają, że nie istnieje korelacja pomiędzy nasileniem trądziku a innymi objawami hiperandrogenizmu u kobiet. Zakładają natomiast występowanie u osób z trądzikiem wzmożonej reakcji gruczołów łojowych na fizjologiczne stężenia androgenów.[1,3]
Estrogeny w naturalny sposób, przez oś sprzężenia zwrotnego, hamują produkcję androgenów i tym samym łoju. Wywierają również efekt miejscowy – zmniejszają sekrecję łoju, bezpośrednio działając na podjednostki α i β receptorów estrogenowych, które znajdują się w gruczołach łojowych mieszków włosowych.
Rola progesteronu nie jest natomiast jednoznaczna. Naturalny progesteron w warunkach fizjologicznych nie nasila łojotoku, jednak jego syntetyczne odpowiedniki mają działanie pobudzające wydzielanie łoju.
Niewiele badań dotyczyło dotychczas działania hormonów tarczycy na poziomie gruczołów łojowych. Ponad 10 lat temu wykazano obecność jądrowych receptorów dla hormonów gruczołu tarczowego na sebocytach. Usunięcie tarczycy zmniejsza tempo wydzielania łoju u szczurów, a suplementacja hormonalna odwraca ten efekt. Na komórkach gruczołów łojowych wykazano również obecnośc receptora MCR-1 i MCR-5 dla melanokortyn (α-MSH, ACTH), co tłumaczy wzrost wydzielania łoju i tym samym nasilenie trądziku w sytuacjach stresowych, gdzie dochodzi do wzrostu poziomu ACTH.[4,8]
Wymienia się także inne hormony, które mogą powodować nasilone wydzielanie łoju. Należy do nich między innymi: hormon wzrostu (GH – growth factor), insulinopodobny czynnik wzrostu (IGF), insulina, hormon stymulujący tarczycę (TSH), hydrokortyzon, hormon uwalniający kortykotropinę (CRH), substancja P.[2]
Podłoże genetyczne
Nie zostało ono dokładnie potwierdzone. Prawdopodobnie rolę odgrywa tu dziedziczenie wielogenowe lub autosomalne dominujące, z różną penetracją genu.[2]