Znaczenie h-FABP w określaniu rokowania u chorych z ACS jest już ustalone. W 2007 r. opublikowano wyniki interesującego badania o akronimie EMMACE-2 (Evaluation of Methods and Management of Acute Coronary Events-2) [24], w którym h-FABP oznaczano między 12 a 24 godziną od początku objawów ACS u 1448 chorych, u których rozpoznano NSTE-ACS (62,9%), STE-ACS (24,8%) lub UA (12,3%). Uczestników badania przydzielono do 4 grup (kwartyle) w zależności od stężenia h-FABP. W analizie wieloczynnikowej uwzględniającej czynniki ryzyka skali GRACE oraz stężenie białka C-reaktywnego (CRP) ryzyko zgonu wzrastało w kolejnych kwartylach stężenia h-FABP (ryc. 3) [24]. Dodatni wynik testu troponinowego nie wpłynął na zmianę wartości prognostycznej h-FABP [24], natomiast stężenie h-FABP >5,8 µg/l identyfikowało chorych wysokiego ryzyka zgonu w ciągu roku od zdarzenia w grupie pacjentów z UA [24]. Szczególną uwagę zwraca większa śmiertelność wśród pacjentów h-FABP (+)/cTn (-) w porównaniu ze śmiertelnością wśród chorych h-FABP (-)/cTn (+) [24].
Porównywalne wyniki otrzymano w wieloczynnikowej analizie przeżycia przeprowadzonej metodą Coxa i uwzględniającej czynniki ryzyka skali GRACE oraz stężenie CRP (ryc. 4) [24].
Wyniki powyższego badania są zbieżne z wynikami pracy autorstwa O’Donoghue i wsp., którzy wykazali przydatność h-FABP w ocenie ryzyka zgonu i wystąpienia złożonego punktu końcowego (zgonu, zawału mięśnia sercowego lub niewydolności serca) w populacji 2287 pacjentów hospitalizowanych z powodu ACS [25]. Związek ten był niezależny od licznych klasycznych czynników ryzyka, w tym charakterystyki demograficznej, rodzaju ACS, klirensu kreatyniny czy stężenia troponiny [25]. Wartość prognostyczną markera wykazano dla wszystkich rodzajów ACS [25]. Potwierdzono również jego użyteczność w ocenie ryzyka zarówno u chorych z zachowaną funkcją nerek (klirens kreatyniny >60 ml/min), jak i z przewlekłą chorobą nerek (klirens kreatyniny <60 ml/min) [25].
Podsumowując, h-FABP jest dobrym wskaźnikiem zgonu i niepożądanych zdarzeń sercowo-naczyniowych w ciągu roku od wystąpienia objawów ACS. Zwiększa on użyteczność powszechnie stosowanej skali GRACE, a także stanowi uzupełnienie w określaniu ryzyka za pomocą oceny stężenia troponiny. Oznaczanie stężenia h-FABP jest szczególnie przydatne w prognozowaniu poważnych zdarzeń sercowo-naczyniowych w grupach chorych dotychczas uważanych za obciążonych mniejszym ryzykiem, czyli z niestabilną chorobą wieńcową i zawałem bez uniesienia odcinka ST.
MikroRNA
MikroRNA (miRNA) to krótkie, niekodujące fragmenty kwasu rybonukleinowego zbudowane z 19-25 nukleotydów. Regulując ekspresję genów przez promowanie degradacji mRNA oraz hamowanie translacji, uczestniczą one w niemal każdym procesie życiowym komórki, m.in. w proliferacji, różnicowaniu, wzroście czy śmierci komórki. Wykazano, że część cząsteczek miRNA jest narządowo lub komórkowo swoista. Chociaż rola miRNA w procesach chorobowych nie została jeszcze poznana, wiadomo, że w warunkach patologii dochodzi do zmiany ich ekspresji, co ma również miejsce w przypadku komórek mięśnia sercowego [26]. Wśród kardiologów miRNA budzi nadzieje przede wszystkim jako element diagnostyki zawału mięśnia sercowego i temu zagadnieniu poświęcona jest większość prac naukowych. Pojawiają się również pierwsze doniesienia dotyczące wartości prognostycznej powyższego biomarkera.
W 2011 r. opublikowano największą pracę o ocenie wartości diagnostycznej i prognostycznej cząsteczek miRNA u pacjentów z ostrym zespołem wieńcowym [27]. U 444 chorych hospitalizowanych z powodu ACS (117 z UA, 131 z NSTE-ACS, 196 z STE-ACS) przy przyjęciu do szpitala oznaczano stężenie hs cTnI oraz stężenie 6 cząsteczek miRNA: miR-1, miR-208a, miR-208b, miR-133a, miR-133b, miR-499, będących głównym przedmiotem badań w tej populacji chorych [27]. Wykazano, że stężenie 3 z 6 badanych cząsteczek miRNA, tj. miR-1, miR-133a i miR-208b, było istotnie większe w grupie NSTE-ACS i STE-ACS w porównaniu z chorymi z UA [27]. W półrocznej obserwacji zmarło 34 chorych (7,7%) [27]. Analiza krzywych przeżycia Kaplana-Meiera wykazała, że stężenie 2 cząsteczek, miR-133a i miR-208b, było istotnie związane z ryzykiem wystąpienia zgonu w ciągu 6 miesięcy od incydentu sercowego [27]. Zależność ta utrzymywała się dla każdej z cząsteczek po skorygowaniu analizy o ryzyko związane z wiekiem i płcią, jednak po skorygowaniu o ryzyko związane ze stężeniem hs cTnT przestała być istotna statystycznie [27]. Nie wykazano związku między stężeniem pozostałych 4 cząsteczek a ryzykiem zgonu [27]. Wartość dyskryminacyjna cząsteczek miR-133a i miR-208b, pozwalająca identyfikować chorych zagrożonych i niezagrożonych zgonem w okresie 6 miesięcy od incydentu, wynosiła dla miR-133a 0,57 (95% PU 0,52-0,62), a dla miR-208b – 0,57 (95% PU 0,50-0,63), ale z niezadowalającym współczynnikiem pola pod krzywą ROC [27]. Żaden z badanych markerów nie wniósł ponadto wartości dodanej względem stężenia hs cTnI [27].
Wyniki pracy Widera i wsp. potwierdzają niestety ograniczoną wartość prognostyczną 2 cząsteczek: miR-133a oraz miR-208b [27]. Przy uwzględnieniu wartości wysokoczułego testu troponinowego przydatność prognostyczna obu biomarkerów przestała być istotna statystycznie. Rola cząsteczek miRNA zarówno w diagnostyce, jak i w ocenie rokowania nie jest oczywiście przesądzona. Trwające badania należą do pionierskich i prowadzone są z udziałem małych grup chorych. Wciąż niezbadana jest wartość rokownicza innych cząsteczek wiązanych z niedokrwieniem mięśnia sercowego, jak miR-499.
Albumina modyfikowana niedokrwieniem
Albumina modyfikowana niedokrwieniem (ischemia modified albumin, IMA) jest białkiem osocza bardzo podatnym na uszkodzenia wywołane takimi czynnikami, jak wolne rodniki, kwasica czy zmniejszona prężność tlenu, dlatego stała się przedmiotem badań dotyczących diagnostyki ACS. W niedokrwieniu mięśnia sercowego dochodzi do zmian konfiguracyjnych N-końcowej części cząsteczki albuminy. Zwiększenie stężenia tak zmodyfikowanej albuminy stwierdza się już w pierwszych minutach od wystąpienia niedokrwienia serca i przez pierwsze 6 godzin. [28,29]. Wzrost stężenia IMA nie jest jednak swoisty dla choroby niedokrwiennej serca. Do zwiększenia stężenia IMA dochodzi w wielu innych chorobach, takich jak stan przedrzucawkowy w ciąży [30], zespół metaboliczny [31], zespół policystycznych jajników [32], retinopatia u osób z cukrzycą [33] czy udar niedokrwienny mózgu [34]. Ze względu na ograniczoną swoistość i niekorzystne porównania z takimi biomarkerami, jak troponina T, mioglobina, kinaza kreatynowa frakcji MB (CK-MB) [35] czy h-FABP [35,36], oznaczanie IMA nie jest zalecane w ocenie niedokrwienia mięśnia sercowego.
Wyniki badań dotyczących wartości prognostycznej IMA napawają nieco większym optymizmem. W badaniu Belle i wsp. u 471 chorych z zawałem mięśnia sercowego (355 z STE-ACS i 115 z NSTE-ACS) włączonych do French Nationwide OPERA Study w ciągu 24 godzin od przyjęcia do szpitala oznaczono w surowicy stężenie troponiny, CRP, BNP (peptyd natriuretyczny typu B) i IMA [37]. Pierwszorzędowy złożony punkt końcowy badania, obejmujący zgon, odwracalne zatrzymanie krążenia, zawał mięśnia sercowego, niewydolność serca lub udar mózgu, wystąpił u 75 chorych (15,6%) w czasie hospitalizacji i u kolejnych 144 (36,6%) w ciągu następnych 12 miesięcy obserwacji [37]. Punkt końcowy wystąpił u 40% pacjentów z górnego kwartylu stężenia IMA (>104 j/ml) w porównaniu z 20% zgonów wśród chorych z kwartylu dolnego (<83 j/ml) [37]. W analizie wieloczynnikowej wykazano 4 niezależne czynniki ryzyka wystąpienia złożonego punktu końcowego w ciągu roku od incydentu: stężenie IMA w surowicy (p=0,01), stężenie BNP (p=0,001), niewydolność serca (p=0,005) i wiek (p=0,003) [37].
Bali i wsp. oceniali wartość rokowniczą IMA w mniejszej i mniej zróżnicowanej grupie chorych z rozpoznanym tylko zawałem typu NSTE-ACS [38]. Do badania włączono 79 chorych, u których oznaczono stężenie IMA w ciągu 24 godzin od przyjęcia [38]. Stężenie IMA było niezależnym czynnikiem ryzyka wystąpienia złożonego punktu końcowego (zgon z przyczyn sercowo-naczyniowych, zawał niezakończony zgonem, nawrót niedokrwienia wymagający pilnej rewaskularyzacji) zarówno w trakcie hospitalizacji, jak i w rocznej obserwacji [38]. Wyznaczona na podstawie krzywej ROC optymalna wartość predykcyjna dla zgonu w ciągu roku od incydentu wynosiła 109 U/ml przy współczynniku pola pod krzywą ROC o wartości 0,79 [38].
Mieloperoksydaza
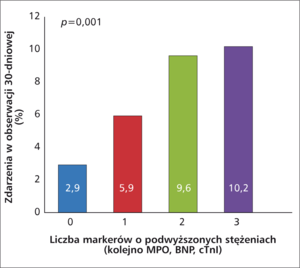
Rycina 5. Wykorzystanie kilku markerów, w tym mieloperoksydazy (MPO), peptydu natriuretycznego typu B (BNP) oraz troponiny I (cTnI), w ocenie rokowania u chorych z NST-ACS w obserwacji 30-dniowej.
Mieloperoksydaza (myeloperoxidase, MPO) jest białkiem znajdującym się głównie w granulocytach obojętnochłonnych, uwalnianym po ich aktywacji, do której dochodzi również w przebiegu niedokrwiennego uszkodzenia mięśnia serca. U chorych z bólem w klatce piersiowej MPO niezależnie od stężenia troponiny T pozwala przewidywać wczesne ryzyko zawału mięśnia sercowego i poważnych zdarzeń sercowych (zawał, ponowny zawał, konieczność rewaskularyzacji lub zgon) w 30-dniowej i 6-miesięcznej obserwacji [39]. Stężenie MPO w przeciwieństwie do troponiny T, CK-MB oraz CRP pozwala identyfikować chorych, u których ryzyko powikłań sercowo-naczyniowych (nawet w przypadku braku martwicy mięśnia serca) jest zwiększone, co sprawia, że ten nowy marker jest szczególnie przydatny w ocenie ryzyka u chorych z bólem w klatce piersiowej [39].
Badanie przeprowadzone w grupie 1090 chorych z ACS wykazało, że stężenie MPO w surowicy nie tylko z dużą siłą przewiduje zwiększone ryzyko powikłań ACS w postaci poważnych zdarzeń sercowych, ale także zwiększa wartości rokownicze tradycyjnych biomarkerów [40]. Potwierdzają to również obserwacje z badania TACTICS-TIMI 18 (Treat Angina with tirofiban and determine Cost of Therapy with an Invasive or Conservative Strategy-Thrombolysis in Myocardial Infarction 18) dotyczące chorych z NST-ACS (ryc. 5) [41]. MPO bierze udział w procesach zapalnych – jest nie tylko ich mediatorem, ale również wskaźnikiem i podkreśla udział granulocytów obojętnochłonnych w patogenezie ACS [40].
Czynnik wzrostu i różnicowania 15
Czynnik wzrostu i różnicowania 15 (growth and differentation factor 15, GDF-15) jest cytokiną z rodziny transformującego czynnika wzrostu β i uczestniczy w procesach zapalnych i apoptozie spowodowanych uszkodzeniem tkanek. Kultury komórek mięśnia sercowego zwiększają produkcję GDF-15 i jego wydzielanie w odpowiedzi na czynnik stresowy, jakim jest niedokrwienie i reperfuzja. Stąd zainteresowanie tym czynnikiem w diagnostyce i prognozowaniu powikłań u chorych z ACS. W badaniu Global Utilization of Strategies to Open Occluded Arteries IV (GUSTO-IV) oceniano stężenie GDF-15 u chorych z NSTE-ACS i jego znaczenie w odniesieniu do innych uznanych markerów [42]. Wykazano jego przydatność w prognozowaniu zgonu w ciągu roku od epizodu NSTE-ACS niezależnie od innych markerów – śmiertelność była największa wśród chorych ze stężeniem GDF-15 >1800 n/l (p <0,001). Wartość prognostyczna GDF-15 była porównywalna z dokonywaną na podstawie łącznej oceny stężenia N-końcowego propeptydu natriuretycznego typu B (NT-proBNP) oraz wieku i wywiadu w kierunku wcześniejszego zawału mięśnia sercowego [42].
Podsumowanie
U chorych z rozpoznanym ostrym zespołem wieńcowym w celu oceny ryzyka groźnych zdarzeń sercowo-naczyniowych Europejskie Towarzystwo Kardiologiczne zaleca oznaczanie biomarkerów o uznanej przydatności diagnostycznej i prognostycznej potwierdzonej w badaniach z udziałem dużych grup chorych. We wczesnej fazie ostrego zespołu wieńcowego, zwłaszcza NSTE-ACS, szczególne znaczenie przypisuje się oznaczaniu troponin, przede wszystkim wykrywanych za pomocą czułych testów [5]. Troponina nie powinna być jednak izolowanym wskaźnikiem warunkującym dalsze decyzje diagnostyczno-terapeutyczne w tej grupie chorych [5]. W późniejszych fazach ACS szczególne znaczenie w określaniu rokowania odgrywa oznaczenie hs CRP i białek natriuretycznych, czyli BNP i NT-proBNP [5]. Białka natriuretyczne szczególne dobrze określają stopień dysfunkcji lewej komory serca [5]. U chorych z NSTE-ACS i podwyższonymi stężeniami BNP lub NT-proBNP, niezależnie od stężenia troponin i hs CRP, ryzyko zgonu jest 3-5 razy większe w porównaniu z chorymi z niskim stężeniem białek natriuretycznych [5]. Stężenia BNP i NT-proBNP w surowicy bardzo dobrze korelują z ryzykiem zgonu nawet po uwzględnieniu wieku, klasy niewydolności serca wg Killipa i frakcji wyrzutowej lewej komory serca [5]. W długoterminowej ocenie ryzyka u chorych z NSTE-ACS, a więc również w planowaniu leczenia przydatność białek natriuretycznych jest niestety ograniczona [5].
Utrzymujące się wysokie stężenia hs CRP wskazują na zwiększone ryzyko powikłań u chorych z ostrym zespołem wieńcowym [5]. Jest to jednak marker o ograniczonej przydatności w rozpoznawaniu ACS [5]. Innym prostym wskaźnikiem ryzyka powikłań jest podwyższone stężenie glukozy we krwi przy przyjęciu do szpitala z powodu ACS [5]. Obecnie nawet większą rolę predykcyjną w ocenie ryzyka zgonu przypisuje się stężeniu glukozy oznaczonemu we wczesnej fazie choroby, ale na czczo w porównaniu z wartościami uzyskanymi bezpośrednio po przyjęciu do szpitala [5].
Oceniając rokowanie u chorych z ACS, należy pamiętać o łatwych do uzyskania w codziennej praktyce lekarskiej wskaźnikach, takich jak morfologia krwi czy parametry wydolności nerek, a zwłaszcza GFR [5]. Rokowanie chorych z ACS istotnie obciąża współistniejąca niedokrwistość, leukocytoza i niski GFR [5].