Przeciwwskazania do wszczepienia układu LVAD
Według obecnych kryteriów istnieje wiele przeciwwskazań względnych lub bezwzględnych do wszczepienia systemu długoterminowego lewokomorowego wspomagania krążenia. Są wśród nich (według wytycznych ISHLT z 2013 roku):3
- potwierdzona zła współpraca w zakresie stosowania się do zaleceń lekarskich
- potwierdzona marskość wątroby lub wysokie wartości wskaźnika Model for End Stage Liver Disease (MELD)
- stała dializoterapia
- ciąża
- uzależnienie od leków lub alkoholu
- choroba psychiczna wymagająca długotrwałej hospitalizacji lub utrudniająca obsługę urządzenia
- niezdolność do obsługi pompy, rozumienia obsługi pompy i alarmów lub warunki życia w trudnym środowisku (brak dostępu do nieprzerwanego zasilania)
- choroba nowotworowa z przewidywanym czasem przeżycia <2 lat
- choroba nerwowo-mięśniowa utrudniająca codzienną obsługę pompy lub poruszanie się
- nieodwracalna niewydolność wielonarządowa
- niedający się naprawić ubytek (pęknięcie) przegrody międzykomorowej lub pęknięcie wolnej ściany lewej komory
- zapalenie wsierdzia z zajęciem zastawek lub odelektrodowe zapalenie wsierdzia z bakteriemią.
Ponadto przeciwwskazaniami są:
- świeży udar mózgu
- tętniak aorty >5 cm.
Czynniki zwiększające ryzyko powikłań
Jednym z ważnych czynników determinujących roczne przeżycie jest stopień zaawansowania niewydolności serca według klasyfikacji INTERMACS. Odsetki rocznego przeżycia chorych, którzy mieli wszczepione urządzenie w trakcie wstrząsu kardiogennego (INTERMACS 1) są najniższe – około 52%, w klasie INTERMACS 2 – 63%, w INTERMACS 3 lub 4 – 78%, w INTERMACS 5 – 93%.2
U kandydatów do przewlekłego wspomagania lewokomorowego bardzo uważnej diagnostyki wymagają stopień wydolności i funkcja prawej komory. Poza elementami badania podmiotowego i przedmiotowego (retencja płynów, rozległość i zasięg obrzęków, wodobrzusze) niezbędna jest dokładna ocena echokardiograficzna prawej komory (jej wielkości oraz parametrów oceniających jej kurczliwość), ewentualnego nadciśnienia i oporów w krążeniu płucnym oraz stopnia dysfunkcji zastawki trójdzielnej. Opracowano liczne skale ryzyka dysfunkcji prawej komory, żadna z nich nie jest jednak powszechnie stosowana. Wszczepialne systemy są zaprojektowane do wspomagania lewej komory i wystąpienie ciężkiej dysfunkcji prawej komory po wszczepieniu LVAD może zniweczyć efekty leczenia. W przypadku współistnienia ciężkiej utrwalonej dysfunkcji prawej komory wymagającej wspomagania obu komór jedyną skuteczną długofalową terapią pozostaje przeszczepienie serca.
Czynnikami ryzyka zgonu we wczesnym okresie po wszczepieniu LVAD są: wiek chorego >65 lat, płeć żeńska, wspomaganie jako terapia docelowa, zwiększone stężenie kreatyniny, mocznika, bilirubiny, zmniejszone stężenie albumin w surowicy, wcześniejsze leczenie kardiochirurgiczne. Najistotniejszymi przyczynami zgonu chorych z LVAD w okresie okołooperacyjnym i w pierwszych 3 miesiącach po zabiegu są niewydolność wielonarządowa, niewydolność prawej komory serca i udary mózgu. W późniejszym okresie najczęstszą przyczyną zgonu staje się udar mózgu.1
Głównymi powikłaniami u chorych z implantowanym lewokomorowym systemem wspomagania o przepływie ciągłym są infekcje w okolicy wyjścia przewodu sterownika (driveline infection), rzadziej uogólnione infekcje związane z urządzeniem. Innym istotnym powikłaniem jest krwawienie z przewodu pokarmowego lub – zazwyczaj groźniejsze – do OUN. Związane jest to z jednej strony ze stosowaniem leczenia przeciwkrzepliwego (warfaryną i kwasem acetylosalicylowym), a z drugiej – ze zmianami w układzie krążenia spowodowanymi prawdopodobnie mniej fizjologicznym przepływem ciągłym w większości współczesnych systemów wspomagania (nabyty zespół niedoboru czynnika von Willebranda, malformacje naczyniowe w śluzówce przewodu pokarmowego). Nie można też pominąć ryzyka dysfunkcji urządzenia spowodowanej tworzeniem się zakrzepów, uszkodzeniem przewodu sterownika lub innymi przyczynami elektromechanicznymi.
Jak wynika z danych raportu INTERMACS z 2017 roku, wolnych od poważnych zdarzeń niepożądanych, takich jak infekcje, krwawienia, udar, dysfunkcja urządzenia, zgon, było w ciągu 3 lat około 20% chorych leczonych wspomaganiem mechanicznym serca.
Z drugiej strony już w pierwszych trzech miesiącach znacznie poprawia się jakość życia chorych. Ta poprawa bez ciężkich zdarzeń niepożądanych utrzymuje się późnej na podobnym poziomie. Paradoksalnie chorzy długo leczeni LVAD często nie zgadzają się na proponowane przeszczepienie serca, w pełni aprobując swoje funkcjonowanie ze wspomaganiem.
Stosowane systemy wspomagania lewokomorowego
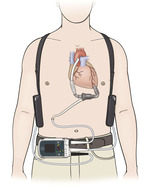
Rycina 2. Pompa HeartMate 2™ – pompa i elementy stale noszone przez chorego. Dzięki uprzejmości St. Jude Medical Inc.
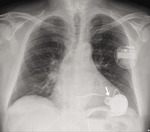
Rycina 3. Zdjęcie RTG P-A chorego z implantowanym systemem HeartWare™ (metalowa kaniula doprowadzająca w koniuszku lewej komory oznaczona strzałką)
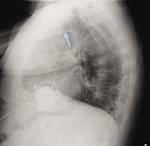
Rycina 4. Zdjęcie RTG chorego z ryciny 3 w projekcji bocznej (długa kaniula odprowadzająca, łącząca pompę z aortą oznaczona strzałką)
Obecnie w Polsce w leczeniu długoterminowym stosowane są dwa urządzenia oparte na zasadzie pompy odśrodkowej do wspomagania lewokomorowego z systemem przepływu ciągłego: HeartMate 3™ (ryc. 1), które zastąpiło HeartMate 2™, czyli pompę liniową o przepływie ciągłym (ryc. 2 ) oraz HeartWare™. Pompa HeartMate 3™ przez okresowe zwiększenie obrotów symuluje częściowo przepływ pulsacyjny.
Oba te systemy mają znak CE i są dopuszczone do użytkowania przez FDA. Metalowa kaniula napływowa umieszczona jest w koniuszku lewej komory (ryc. 3), a jej wlot zwykle ustawiony jest w kierunku zastawki dwudzielnej. Kaniula odpływowa urządzenia zlokalizowana jest w części wstępującej aorty (ryc. 4). Pompa zespolona z kaniulą napływową umieszczana jest w całości w klatce piersiowej w przestrzeni osierdziowej.
