Związek między epizodami niedokrwienia OUN a nieprawidłowościami przegrody międzyprzedsionkowej
U prawie połowy pacjentów poniżej 55 roku życia, którzy przebyli udar niedokrwienny mózgu, nie udaje się ustalić jego przyczyny.1 Epizody te określa się mianem udarów kryptogennych. Częstość występowania PFO w tej populacji jest około dwukrotnie większa w porównaniu z populacją ogólną. Sugeruje się więc związek między PFO a epizodami niedokrwiennymi mózgu w mechanizmie zatorowości skrzyżowanej. W sytuacjach prowadzących do zwiększonego ciśnienia w prawym przedsionku (kaszel, defekacja, podnoszenie ciężarów) dochodzi do przecieku krwi z prawego do lewego przedsionka serca oraz przedostania się materiału zatorowego pochodzącego głównie z żył głębokich kończyn dolnych i miednicy mniejszej do krążenia systemowego, w tym do OUN. Do czynników zwiększających ryzyko udaru kryptogennego u pacjentów z PFO zalicza się obecność zastawki Eustachiusza, siatki Chiariego, duży rozmiar kanału, ASA.4 Możliwe jest także tworzenie i uwalnianie skrzepliny w kanale PFO, szczególnie w przypadku występowania tętniakowato poszerzonej przegrody międzyprzedsionkowej.
Sugerowany związek między PFO a migrenowymi bólami głowy przebiegającymi z aurą jest tłumaczony przedostawaniem się przez kanał PFO mikrozatorów powodujących skurcz tętnic mózgowych, zmniejszony przepływ krwi i przemijające niedokrwienie ośrodkowego układu nerwowego. Drugim przypuszczalnym mechanizmem jest migracja substancji wazoaktywnych przez PFO do krążenia systemowego z ominięciem płuc, gdzie ulegają degradacji.15 Podejrzewa się także związek między PFO a chorobą dekompresyjną u nurków oddychających sprzężonym powietrzem. Dekompresja podczas wynurzania się prowadzi do powstawania w tkankach pęcherzyków gazu, które przedostając się do krążenia żylnego, mogą migrować przez kanał PFO do krążenia systemowego, powodując zator gazowy.15
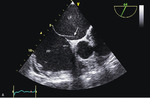
Rycina 2. Przetrwały otwór owalny (strzałka) (A). Echokardiograficzne badanie przezprzełykowe. Po podaniu środka cieniującego kilkanaście pęcherzyków przepłynęło do lewego przedsionka (B)
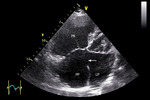
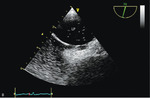
Rycina 3. Ubytek przegrody międzyprzedsionkowej typu otwór pierwotny. Echokardiograficzne badane przezklatkowe, projekcja koniuszkowa. Przeciążenie objętościowe prawego przedsionka i prawej komory powoduje ich powiększenie. Strzałka wskazuje ubytek, zawsze zlokalizowany w dolnej części przegrody, w bezpośrednim kontakcie z pierścieniami zastawek przedsionkowo-komorowych, położonymi na tym samym poziomie.
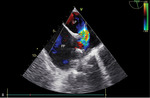
Rycina 4. Ubytek typu żyła główna górna (strzałka). Echokardiograficzne badanie przezprzełykowe, ujęcie podłużne (A). Nad ubytkiem, w pozycji „jeździec” (overriding) znajduje się żyła główna górna (gwiazdka). Badanie dopplerowskie znakowane kolorem wykazuje przeciek międzyprzedsionkowy (B)
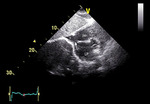
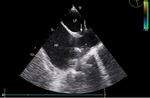
Rycina 5. Ubytek przegrody międzyprzedsionkowej typu żyła główna dolna (strzałka). Badanie echokardiograficzne przezklatkowe, projekcja podmostkowa. Żyła główna dolna (gwiazdka) znajduje się poniżej ubytku w pozycji „jeździec” (overriding)
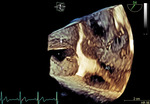
Rycina 6. Ubytek przegrody międzyprzedsionkowej typu otwór wtórny (gwiazdka). Echokardiograficzne badanie przezprzełykowe 3D. Strzałka wskazuje na wiotki fragment przegrody międzyprzedsionkowej, mobilny w trakcie cyklu serca, co wpływa znacząco na rozmiar ubytku i jego powierzchnię
Ze względu na rzadsze występowanie ASD potencjalny związek z epizodami niedokrwiennymi jest słabiej dowiedziony w porównaniu z PFO. Ubytek przegrody międzyprzedsionkowej występował u 12% spośród 103 pacjentów w średnim wieku 52 lat, którzy przebyli udar kryptogenny.16 Przeprowadzone przez Bannana i wsp.17 porównanie pacjentów z ASD, którzy przebyli lub nie zatorowość skrzyżowaną, wykazało, że czynnikami ryzyka były młodszy wiek pacjentów oraz mniejszy rozmiar ubytku. Autorzy sugerują, że mniejszy rozmiar ubytku z niskim systemowym oporem naczyniowym może ułatwiać przeciek prawo-lewy. Rigatelli i wsp.18 potwierdzili doniesienia poprzedników o zwiększonym ryzyku zatorowości u pacjentów z mniejszym ubytkiem. Nie należy także zapominać o przebudowie prawego przedsionka wskutek przeciążenia objętościowego, która prowadzi do migotania przedsionków i zwiększonego ryzyka zatorowości systemowej.
Diagnostyka
Diagnostykę w kierunku PFO należy prowadzić u pacjentów po przebytym udarze kryptogennym. Badanie przedmiotowe, elektrokardiograficzne, rentgenogram klatki piersiowej są zwykle prawidłowe. Ze względu na mały rozmiar PFO i często przejściowy charakter przecieku echokardiograficzne badanie przezklatkowe (TTE – transthoracic echocardiography) ma ograniczone zastosowanie w jego obrazowaniu. Pomocne może być dożylne podanie środka cieniującego, którym najczęściej jest wstrząśnięta sól fizjologiczna.4 Obecność pęcherzyków gazu w lewym przedsionku w trakcie pierwszych trzech cykli pracy serca od pojawienia się ich w prawym przedsionku sugeruje przeciek przez PFO. Dyskusyjne pozostaje to, czy liczba przechodzących mikropęcherzyków świadczy o wielkości przecieku.14,19 Badanie powinno być wykonane w spoczynku, a następnie w trakcie kaszlu lub manewru Valsalvy, które podnoszą ciśnienie w prawym przedsionku i zwiększają przeciek. O ile TTE z podaniem środka cieniującego może być traktowane jako badanie przesiewowe w diagnostyce PFO, o tyle echokardiograficzne badanie przezprzełykowe (TEE – transesophageal echocardiography) jest metodą referencyjną, umożliwiającą nie tylko potwierdzenie rozpoznania, ale także dokładną ocenę długości i szerokości kanału PFO, stwierdzenie współwystępowania ASA, obecności zastawki Eustachiusza czy siatki Chiariego oraz wykluczenie obecności skrzepliny w uszku lewego przedsionka (ryc. 2). Alternatywną metodą obrazową w diagnostyce PFO jest badanie dopplerowskie transkranialne (TCD – transcranial doppler), wykrywające pęcherzyki powietrza w tętnicach mózgu zarówno po podaniu środka cieniującego w spoczynku, jak i po próbie Valsalvy. Zaletą jest nieinwazyjny charakter badania, wadą natomiast – brak możliwości oceny anatomii przegrody międzyprzedsionkowej i przecieku.
Diagnostyka ASD obejmuje badanie podmiotowe i przedmiotowe, elektrokardiograficzne oraz zdjęcie rentgenowskie klatki piersiowej. Podstawą obrazowania jest TTE, w którym można stwierdzić powiększenie jam prawej części serca i paradoksalny ruch przegrody międzykomorowej w razie dużego przecieku (ryc. 3). Inną cechą jest poszerzenie pnia płucnego i jego gałęzi oraz przyspieszenie prędkości przepływu do łożyska płucnego. Oceniając anatomię ubytku, należy określić jego wielkość, położenie oraz odległość od otaczających struktur. Stosunek objętości przepływu płucnego do systemowego (Qp/Qs) >1,5 świadczy o istotnym hemodynamicznie przecieku. Oszacowanie tego parametru w praktyce może być trudne, dlatego należy zachować ostrożność podczas interpretacji uzyskanych wyników. Konieczne są ocena niedomykalności zastawki trójdzielnej i oszacowanie skurczowego ciśnienia w jamie prawej komory. Należy zwrócić uwagę na dodatkowe patologie – nieprawidłowy spływ żył płucnych w przypadku svASD (ryc. 4 i 5) czy niedomykalność lewej zastawki przedsionkowo-komorowej wynikającą z rozszczepienia jej przedniego płatka u chorych z ASD I. Poszerzona zatoka wieńcowa przy współistnieniu następstw istotnego przecieku międzyprzedsionkowego przemawia za rozpoznaniem csASD. Metodą uzupełniającą badanie przezklatkowe jest TEE. W przypadku ASD II obrazuje wielkość i położenie ubytku, morfologię rąbków otaczających ubytek, relację do otaczających tkanek, ujść żył płucnych, co określa możliwość jego zamknięcia przeznaczyniowego. Dodatkowych informacji dostarcza trójwymiarowe badanie przezprzełykowe (3D TEE – three-dimensional transesophageal echocardiography), które pozwala na analizę zmieniającej się zależnie od cyklu serca morfologii ubytku i otaczających struktur (ryc. 6).4
Leczenie
Wskazania do leczenia interwencyjnego
Nierandomizowane badania obserwacyjne wykazywały korzyści płynące z przezskórnego zamknięcia PFO w postaci zmniejszonego ryzyka powtórnych incydentów niedokrwiennych oraz bezpieczeństwa zabiegu.20,21 Opublikowane w 2012 roku wyniki pierwszego randomizowanego prospektywnego badania CLOSURE I,22 a następnie kolejnych dwóch – PC Trial23 i RESPECT24 – nie potwierdziły jednak przewagi leczenia interwencyjnego PFO nad farmakologicznym w prewencji wtórnej udaru niedokrwiennego mózgu, a wręcz wykazały większe ryzyko powikłań naczyniowych oraz migotania przedsionków w grupie leczonej inwazyjnie. Wzbudziły tym samym ożywioną dyskusję na temat celowości takiego postępowania. Dopiero przedłużona obserwacja pacjentów z badania RESPECT wykazała zmniejszoną liczbę udarów kryptogennych w grupie leczonych interwencyjnie w porównaniu z terapią zachowawczą. Opublikowane w 2017 roku wyniki kolejnego randomizowanego prospektywnego badania CLOSE25 wykazały zmniejszenie częstości występowania kolejnego udaru niedokrwiennego mózgu u pacjentów poniżej 60 roku życia leczonych interwencyjnie, a następnie farmakologicznie, w stosunku do pacjentów leczonych tylko farmakologicznie, szczególnie w przypadku współistnienia ASA i istotnego przecieku międzyprzedsionkowego (definiowanego w tym badaniu jako przechodzenie >30 pęcherzyków środka cieniującego do lewego przedsionka), co zostało potwierdzone w badaniu Gore REDUCE.26 Niedawno opublikowana metaanaliza Ahmada i wsp.27 wykazała, że przezskórne zamknięcie PFO zmniejsza ryzyko powtórnego udaru niedokrwiennego mózgu u pacjentów z istotnym przeciekiem, ale nie ze współwystępującym ASA. W efekcie obecne wytyczne nie są zgodne co do proponowanego postępowania. Według ekspertów American Heart Association (AHA) i American Stroke Association (ASA)28 można rozważyć interwencyjne zamknięcie PFO u pacjentów z przebytym udarem kryptogennym i współistniejącą zakrzepicą żył głębokich. W opinii ekspertów American Academy of Neurology (AAN)29 można rozważyć leczenie inwazyjne PFO przy użyciu zapinki Amplatzer PFO Occluder u pacjentów z udarem kryptogennym nawracającym mimo leczenia farmakologicznego.
Warto podkreślić, że PFO jest wariantem anatomicznym zdrowego serca i nie należy go zamykać w ramach prewencji pierwotnej udaru niedokrwiennego mózgu. Nie ma także wystarczających danych potwierdzających słuszność takiego postępowania w leczeniu migrenowych bólów głowy czy przemijających ataków niedokrwiennych. Nie istnieje także jedna strategia leczenia farmakologicznego. W przeprowadzonych dotychczas prospektywnych badaniach randomizowanych u pacjentów z PFO leczonych zachowawczo stosowano leki przeciwpłytkowe (kwas acetylosalicylowy w monoterapii lub w połączeniu z dipirydamolem w postaci o powolnym uwalnianiu, klopidogrel lub podwójna terapia przeciwpłytkowa z zastosowaniem kwasu acetylosalicylowego i klopidogrelu) oraz przeciwkrzepliwe (antagoniści witaminy K, doustne antykoagulanty: rywaroksaban, apiksaban, dabigatran). W żadnym z nich nie porównywano jednak skuteczności ani bezpieczeństwa terapii zachowawczej w tej grupie pacjentów.22-26
Wskazaniem do zamknięcia ASD jest istotny czynnościowo przeciek powodujący powiększenie jam prawej części serca, gdy naczyniowy opór płucny wynosi <2,3 jednostki Wooda. Decyzja dotycząca leczenia interwencyjnego w przypadku naczyniowego oporu płucnego między 2,3 a 4,6 jednostki Wooda powinna zostać podjęta indywidualnie u każdego pacjenta w ośrodku referencyjnym. Pacjenci z wyższym oporem płucnym nie są kandydatami do leczenia zabiegowego.30 Szczególnym wskazaniem do zamknięcia wszystkich rodzajów ASD, niezależnie od rozmiaru ubytku, jest przebyty zator skrzyżowany, po wykluczeniu jego innych przyczyn.6
Zamknięcie przezskórne jest obecnie metodą z wyboru leczenia ASD II. Do zabiegu kwalifikowani są pacjenci ze średnicą ubytku nieprzekraczającą 38 mm zmierzoną cewnikiem z balonem oraz z obecnością co najmniej pięciomilimetrowego rąbka otaczającego ubytek z wyjątkiem segmentu podaortalnego. Takie warunki spełnia około 80% ASD II. W pozostałych przypadkach, a także w innych rodzajach ASD, stosuje się leczenie chirurgiczne.6