Czy można zapobiegać toksycznemu uszkodzeniu serca u pacjentów z chorobą nowotworową?
prof. dr hab. n. med. Ewa Lewicka
- U wielu osób kardiotoksyczność leczenia przeciwnowotworowego jest rozpoznawana zbyt późno, dopiero po wystąpieniu objawów związanych z rozwojem choroby układu sercowo-naczyniowego, dlatego konieczne są: identyfikacja chorych z grupy dużego ryzyka, a w czasie leczenia onkologicznego – wczesne rozpoznawanie kardiotoksyczności i wdrażanie właściwego postępowania
- W artykule omówiono najważniejsze zagadnienia dotyczące zapobiegania i wykrywania powikłań kardiologicznych leczenia onkologicznego, które mogą być przydatne w codziennej pracy kardiologów
Postęp, jaki dokonał się w zakresie wczesnego rozpoznawania nowotworów, i wprowadzenie nowych, skuteczniejszych metod leczenia sprawiły, że choroba nowotworowa w wielu przypadkach przestała być postrzegana jako wyrok. Zwiększa się populacja osób wyleczonych, a u innych pacjentów staje się ona chorobą przewlekłą, kontrolowaną dzięki długoterminowemu leczeniu. Utrzymuje się tendencja do stałego wzrostu przeżywalności w nowotworach wieku dziecięcego. W raku piersi, który jest najczęstszym nowotworem wśród kobiet, 60% chorych z wczesnym stadium przeżywa ponad 20 lat1.
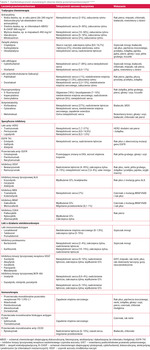
Niestety wiele leków onkologicznych wywiera szkodliwy wpływ na układ sercowo-naczyniowy. Wykazano to zarówno w przypadku nadal często stosowanej radioterapii, jak i tradycyjnej chemioterapii z użyciem antracyklin, cyklofosfamidu, taksanów czy fluoropirymidyn, a także nowszych leków – przeciwciał monoklonalnych, inhibitorów kinaz tyrozynowych (TKIs – small-molecule tyrosine kinase inhibitors) – oraz najnowszych, czyli leków o działaniu immunologicznym. Zakres kardiotoksyczności jest bardzo szeroki (tab. 1) i obejmuje dysfunkcję skurczową lewej komory (LVD – left ventricular dysfunction), niewydolność serca (HF – heart failure), chorobę wieńcową (CAD – coronary artery disease), nadciśnienie tętnicze (HA – arterial hipertension), wady zastawkowe, zapalenie osierdzia, zaburzenia rytmu i powikłania zakrzepowo-zatorowe.
Kardioonkologia jest stosunkowo nową dziedziną, której zadaniem jest zapewnienie jak najlepszej profilaktyki i leczenie powikłań kardiologicznych terapii przeciwnowotworowej. W tym celu często konieczne jest wielodyscyplinarne działanie, a przede wszystkim dobra współpraca kardiologów i onkologów. Przy czym o ile onkolog ma decydujący głos w kwestii wyboru terapii przeciwnowotworowej, o tyle rolą kardiologa jest podejmowanie działań w celu oceny chorego przed zastosowaniem potencjalnie kardiotoksycznego leczenia, monitorowania przebiegu tego leczenia oraz niezwłocznego wdrożenia właściwego postępowania w przypadku wystąpienia objawów uszkodzenia układu sercowo-naczyniowego.
Ocena ryzyka kardiotoksyczności i występowania choroby sercowo-naczyniowej przed leczeniem onkologicznym
Do grupy ryzyka wystąpienia kardiotoksyczności należą osoby młode (<18 lat) i pacjenci w starszym wieku (>60-65 lat) z rozpoznaną chorobą sercowo-naczyniową (CVD – cardiovascular disease), czynnikami ryzyka sercowo-naczyniowego oraz poddawani w przeszłości radio- lub chemioterapii, zwłaszcza z zastosowaniem antracyklin. Choroba serca i nowotwór mają wiele wspólnych czynników ryzyka, takich jak wiek, płeć, HA, cukrzyca, dyslipidemia, otyłość i palenie tytoniu, dlatego ich skuteczne leczenie, zaprzestanie palenia tytoniu, zdrowy sposób odżywiania i systematyczny wysiłek fizyczny przynoszą wymierne korzyści w obu tych schorzeniach. Stosowanie (jeżeli są wskazane) inhibitorów konwertazy angiotensyny (ACEI – angiotensin converting enzyme inhibitors), antagonistów receptora angiotensyny (ARB – angiotensin receptor blockers) oraz ß-adrenolityków (zwłaszcza karwedilolu) może działać dodatkowo kardioprotekcyjnie w czasie leczenia onkologicznego.
Obecność czynników ryzyka sercowo-naczyniowego zwiększa przede wszystkim ryzyko wystąpienia LVD, będącej najczęstszym objawem kardiotoksyczności. Nawet bezobjawowa LVD pogarsza odległe rokowanie kardiologiczne, a ponadto może ograniczać możliwości skutecznego leczenia onkologicznego, pogarszając tym samym rokowanie w chorobie zasadniczej.
Ryzyko rozwoju LVD i HF dotyczy przede wszystkim osób leczonych antracyklinami, które są stosowane głównie w raku piersi, białaczkach, chłoniakach, mięsakach tkanek miękkich i nowotworach dziecięcych. Wprawdzie rzadziej, ale LVD i HF mogą wystąpić u chorych leczonych taksanami (docetaksel), inhibitorami proteasomu (karfilzomib) lub TKIs (sunitynib, sorafenib).
Ryzyko wystąpienia LVD po antracyklinach jest zwiększone u osób w wieku >60 lat i dodatkowo w przypadku występowania przynajmniej dwóch z następujących czynników ryzyka: HA, cukrzyca, dyslipidemia, otyłość i palenie tytoniu2-4. Dotyczy to także chorych z już rozpoznaną CVD (zwłaszcza po zawale serca lub z wadą zastawkową) i stosujących dodatkowo leki anty-HER2, cyklofosfamid, taksany oraz po napromienianiu klatki piersiowej lub śródpiersia. Najistotniejszym czynnikiem ryzyka HF jest całkowita zastosowana dawka antracyklin, zwłaszcza >550 mg/m2 dla doksorubicyny (>900 mg/m2 dla epirubicyny)2,5. We współczesnych schematach leczenia raka piersi i chłoniaków stosuje się mniejsze dawki doksorubicyny, odpowiednio 240 mg/m2 i 300-400 mg/m2 (wg schematu R-CHOP, tj. schematu chemioterapii stosowanego w leczeniu chłoniaków nieziarniczych: rytuksymab, cyklofosfamid, doksorubicyna, winkrystyna, prednizolon), co stanowi istotny element zapobiegania kardiomiopatii poantracyklinowej. Należy jednak pamiętać o indywidualnej predyspozycji, być może uwarunkowanej genetycznie, bowiem u niektórych chorych stwierdzano LVD po mniejszych dawkach antracyklin.
Ważnym elementem oceny kardiologicznej przed rozpoczęciem leczenia onkologicznego jest zebranie wywiadu na temat występowania dolegliwości dławicowych, duszności wysiłkowej, obrzęków, omdleń, kołatań serca, chromania przestankowego i ustalenie, czy nie są one objawem nierozpoznanej dotąd choroby serca. Zaleca się wykonanie przesiewowego badania EKG dla oceny rytmu serca, odstępu QT i wykrywania bezobjawowego niedokrwienia. U osób, u których planowana jest chemioterapia związana z ryzykiem wystąpienia LVD, zalecane jest wykonanie badania echokardiograficznego5. Antracykliny są względnie przeciwwskazane u pacjentów z HF lub z frakcją wyrzutową lewej komory (LVEF – left ventricular ejection fraction) <45%.
Rozpoznanie choroby serca u pacjenta kwalifikowanego do leczenia onkologicznego implikuje zastosowanie odpowiedniego leczenia zgodnie z obowiązującymi wytycznymi. Jednak w przypadku zaawansowanej CVD, np. trójnaczyniowej CAD lub ciężkiej stenozy zastawki aortalnej u chorego, u którego wymagane jest szybkie wdrożenie leczenia przeciwnowotworowego, często konieczne jest indywidualne podejście. Niezbędne może być ustalenie dalszego postępowania w zespole z udziałem onkologa, kardiologa i kardiochirurga. Preferowane są zabiegi przezcewnikowe, ponieważ operacja kardiochirurgiczna i okres rekonwalescencji mogą opóźniać rozpoczęcie terapii przeciwnowotworowej. Należy również dążyć do minimalizowania przedłużonej antykoagulacji i leczenia przeciwpłytkowego, które nasilają toksyczność hematologiczną chemioterapii.
Podsumowując, w przypadku osób zakwalifikowanych do potencjalnie kardiotoksycznego leczenia onkologicznego zadaniami kardiologa są ocena czynników ryzyka sercowo-naczyniowego oraz optymalna ich kontrola. To pierwsze bardzo istotne działania w zakresie prewencji pierwotnej kardiotoksyczności. Natomiast u chorych z rozpoznaną CVD oprócz jej leczenia istotne jest ustalenie strategii dalszego monitorowania kardiologicznego w czasie terapii onkologicznej.
Wczesne wykrywanie kardiotoksyczności
Obecnie główną strategią w kardioonkologii jest szybkie rozpoznawanie wczesnej kardiotoksyczności zastosowanego leczenia onkologicznego i wdrożenie odpowiedniego postępowania. Stale poszukuje się metod, które pozwoliłyby na jej wykrywanie jeszcze w okresie przedklinicznym, zanim dojdzie do obniżenia LVEF i wystąpienia objawów.