Do rozpoznania hemochromatozy wrodzonej (HFE-HC) wystarcza stwierdzenie mutacji C282Y genu HFE i podwyższonych parametrów gospodarki żelazowej, niezależnie od występowania lub nie objawów klinicznych choroby.
NMR umożliwia oszacowanie zasobów żelaza w tkance parenchymalnej, a badanie metodą TK obrazuje cechy zaawansowanej marskości wątroby. Niemniej we wcześniejszych stadiach choroby biopsja wątroby odgrywa ważną rolę w ocenie stopnia zwłóknienia narządu. Należy ją wykonywać u chorych >40 r.ż., z hepatomegalią, podwyższoną aktywnością aminotransferazy asparaginianowej (AspAT – aspartate aminotransferase) lub alaninowej (AlAT – alanine aminotransferase) oraz stężeniem ferrytyny >1000 μg/l.11,13 Stężenie ferrytyny <1000 μg/l oraz prawidłowa aktywność AspAT, przy braku hepatomegalii, pozwala wykluczyć zaawansowane włóknienie wątroby z 95% prawdopodobieństwem.13 Osoczowe stężenie ferrytyny można uznać za pojedynczy marker zaawansowanego włóknienia wątroby u pacjentów nosicieli obu zmutowanych alleli C282Y genu HFE.11 Wskazaniem do biopsji może być również podwyższenie parametrów gospodarki żelazowej lub kliniczne objawy przeładowania organizmu żelazem u pacjentów, u których nie stwierdzono mutacji C282Y czy H63D.11 Kwas hialuronowy oraz elastografia również mogą być przydatne w ocenie zaawansowanego włóknienia wątroby, ale nie są jeszcze szeroko stosowane w diagnostyce.16,17
Na rycinie 1 przedstawiono algorytm diagnostyczno-leczniczy w hemochromatozie wrodzonej według zaleceń AASLD.
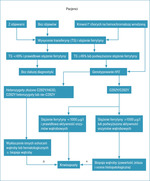
Rycina 1. Algorytm postępowania diagnostyczno-leczniczego w hemochromatozie wątrobowej (wg 11 pozycji piśmiennictwa)
Leczenie
Nie ma, niestety, danych jednoznacznie wskazujących na właściwy moment włączenia terapii hemochromatozy wrodzonej, gdyż nie określono stężenia żelaza, od którego rozpoczyna się uszkadzanie komórek i tkanek ani nie wykazano związku między zawartością żelaza w wątrobie, stężeniem ferrytyny a stopniem uszkodzenia wątroby. Najpowszechniejszym sposobem leczenia są krwioupusty. Ewakuacja 500 ml krwi pełnej pozwala na usunięcie ok. 250 mg żelaza. Związki chelatujące żelazo (deferoksamina, deferazyroks) ze względu na niższą skuteczność (jednorazowo usuwają ok. 100 mg żelaza z organizmu) stosuje się u chorych, którzy nie tolerują krwioupustów bądź nie mogą być im poddawani. Wskazaniami do ich wdrożenia są zespoły dyserytropoetyczne i przewlekła niedokrwistość hemolityczna.11 Najrzadziej stosowaną metodą leczenia jest erytrocytofereza.13
Rozpoczęcie leczenia krwioupustami, zanim dojdzie do rozwoju marskości wątroby czy cukrzycy, znacząco obniża chorobowość i śmiertelność w przebiegu hemochromatozy wrodzonej. Zaleca się więc włączenie terapii u chorych bez objawów, którzy są homozygotami C282Y genu HFE i stwierdza się u nich podwyższone parametry gospodarki żelazowej (ferrytyna >1000 μg/l), a także u pacjentów z objawami choroby czy cechami uszkodzenia narządów miąższowych. Postępowanie takie jest zasadne m.in. z uwagi na to, że HCC zdecydowanie rzadziej się rozwija u chorych bez dokonanej marskości wątroby. Ponieważ HCC jest przyczyną ok. 30% zgonów u chorych na hemochromatozę wrodzoną, a powikłania marskości wątroby 20% zgonów, u pacjentów z marskością wątroby w przebiegu hemochromatozy wrodzonej należy regularnie, co 6 miesięcy, wykonywać badanie USG jamy brzusznej.11 Kwestię dyskusyjną stanowi natomiast terapia krwioupustami u chorych będących nosicielami obu zmutowanych alleli C282Y genu HFE, z prawidłową aktywnością enzymów wątrobowych, bez objawów klinicznych oraz z miernie podwyższonym stężeniem ferrytyny (<1000 μg/l). Wydaje się, że mimo braku przekonujących danych z badań i publikacji należy jednak rozważać u nich taką metodę leczenia.11
Krwioupusty powinny być prowadzone początkowo raz w tygodniu (niemniej w zależności od tolerancji chorego możliwe jest wydłużenie odstępu czasowego do jednego razu na 2 tygodnie), do czasu osiągnięcia saturacji transferyny <45-50% oraz, przede wszystkim, stężenia ferrytyny 50-100 μg/l lub wystąpienia anemizacji (obniżenia hematokrytu/hemoglobiny <80% poziomu wyjściowego).11 Następnie krwioupusty prowadzi się w ramach leczenia podtrzymującego, zwykle raz na 3-6 miesięcy, i kontroluje stężenie ferrytyny co ok. 3 miesiące. Nie ma jednak dostatecznej liczby badań, które pozwoliłyby na stworzenie protokołu wenesekcji opartego na faktach, a powyższe dane wynikają z doświadczenia zajmujących się taką terapią ośrodków i opierają się na dostępnym piśmiennictwie.10,11,13
Skuteczność terapii krwioupustami zależy od stopnia uszkodzenia narządów w momencie rozpoczęcia leczenia. Zwykle poprawia się stopień przewlekłego zmęczenia, zmniejsza się natężenie bólów brzucha i nadmierna pigmentacja skóry, spada aktywność aminotransferaz, a także poprawia się kontrola glikemii. Obserwowano również regresję włóknienia wątroby, a nawet zmniejszanie się żylaków przełyku u chorych z dokonaną marskością wątroby.18,19 Krwioupusty najczęściej jednak nie wpływają na dolegliwości stawowe czy ryzyko rozwoju HCC u chorych z dokonaną marskością wątroby w przebiegu hemochromatozy wrodzonej, a wpływ na układ dokrewny czy serce zależy od wyjściowego stopnia ich uszkodzenia.13 U chorych, u których wcześnie rozpoczęto leczenie, czas przeżycia będzie zbliżony do tego w populacji ogólnej.
Niewydolność wątroby z wodobrzuszem, encefalopatią, krwawieniami z żylaków przełyku czy rozwój HCC są wskazaniami do rozważenia przeszczepienia wątroby. Publikowane wyniki były jednak nieco gorsze niż w przypadku transplantacji z innych wskazań: rok przeżywało 64% pacjentów (podczas gdy średnie roczne przeżycie u chorych po transplantacjach wykonanych w Europie po 1999 r. wynosiło ok. 84%), a pięć lat ok. 34% (w innych wskazaniach średnio 75%), co wiązało się najprawdopodobniej z wyjściowym uszkodzeniem innych narządów i większym odsetkiem osób z niewydolnością serca, zakażeniami i chorobami nowotworowymi.20 Obecnie jednak wyniki przeszczepienia wątroby poprawiają się i stają się zbliżone do uzyskiwanych w innych wskazaniach, co zapewne wynika ze skuteczniejszego leczenia chorych przed zabiegiem, szczególnie krwioupustami.21
W zaleceniach dietetycznych dla chorych poddawanych regularnym krwioupustom zawarto jedynie ograniczenia w stosowaniu suplementów wielowitaminowych zawierających żelazo, a także witaminy C w dawce przekraczającej 500 mg/24 h. Picie herbaty prawdopodobnie obniża stężenie żelaza zapasowego u chorych z hemochromatozą wrodzoną,22 chociaż nie potwierdzono tego w innych badaniach.23 Pacjenci powinni także stosować ogólnie przyjęte zalecenia dotyczące rozsądnej diety i trybu życia. Alkohol nasila uszkodzenie wątroby w mechanizmie stresu oksydacyjnego, intensyfikuje wchłanianie żelaza w jelicie cienkim oraz hamuje wątrobową ekspresję hepcydyny, dlatego chorym z hemochromatozą wrodzoną zaleca się ograniczenie jego spożywania.13
Podsumowanie
Hemochromatoza wrodzona (HC) jest dziedziczonym autosomalnie recesywnie schorzeniem, w przebiegu którego przy prawidłowej erytropoezie dochodzi do kumulacji żelaza w tkance parenchymalnej wątroby, serca i gruczołów wydzielania wewnętrznego. Proces ten może prowadzić do zaawansowanego uszkodzenia tych narządów. Główną przyczyną choroby, u ok. 80% osób, jest mutacja C282Y genu HFE, który jest regulatorem hepcydyny – najważniejszego hormonu regulującego gospodarkę żelazową u człowieka. Mutacje innych genów regulatorowych są rzadsze (nie-HFE-hemochromatoza). Mimo częstego występowania mutacji C282Y u ludzi rasy białej objawy hemochromatozy rozwijają się rzadko, co wynika z niskiej penetracji genu. Do rozpoznania choroby wymagane jest stwierdzenie podwyższonej saturacji transferyny i wysokiego stężenia ferrytyny oraz homozygotycznego genotypu C282Y genu HFE. Badania obrazowe, np. NMR, oraz biopsja wątroby pozwalają na ocenę depozytów żelaza i zaawansowania włóknienia wątroby. Leczenie polega na stosowaniu powtarzanych krwioupustów, prowadzonych do czasu osiągnięcia prawidłowych parametrów gospodarki żelazowej. Następnie wykonuje się je w ramach terapii podtrzymującej przez całe życie chorego. Wskazane jest także istotne ograniczenie spożycia alkoholu.