Program edukacyjny: kardiologia
Leczenie reperfuzyjne u chorych ze STEMI, u których prawdopodobne jest opóźnienie terapii
David M. Larson, MD
Timothy D. Henry, MD
W SKRÓCIE
Pierwotna przezskórna angioplastyka wieńcowa (pPCI) jest optymalną metodą reperfuzji u chorych z zawałem serca przebiegającym z uniesieniem odcinka ST (STEMI), pod warunkiem że zostanie wykonana przez doświadczony personel na czas. Niestety, w USA zaledwie 25% szpitali ma możliwość przeprowadzania przezskórnej angioplastyki wieńcowej (PCI). Jak wykazano, przewiezienie chorego do innego szpitala w celu wykonania pierwotnej przezskórnej angioplastyki również poprawia rokowanie, o ile transport zajmuje niewiele czasu i zabieg może być przeprowadzony w czasie krótszym niż 90 minut od momentu przybycia pacjenta do pierwszego szpitala. W wielu przypadkach szybki transport chorych z zawałem serca z uniesieniem odcinka ST jest jednak niemożliwy ze względu na dużą odległość między ośrodkami, niekorzystne warunki pogodowe czy opóźnienia w samym systemie opieki zdrowotnej. Najnowsze dane potwierdzają, że wdrożenie w takich sytuacjach leczenia fibrynolitycznego i przewiezienie chorego do innego ośrodka w celu wykonania przezskórnej angioplastyki wieńcowej jest skuteczne. Wciąż dyskutowany jest wybór optymalnego momentu przeprowadzenia zabiegu (od razu, odroczone, ratunkowe). Duży wpływ na umieralność w przypadku PCI ma czas do uzyskania reperfuzji, choć większą rolę odgrywa on w leczeniu fibrynolitycznym. Optymalizacja, czyli maksymalne skrócenie, czasu do skutecznej reperfuzji serca u chorych z zawałem serca przebiegającym z uniesieniem odcinka ST wymaga od wszystkich szpitali wdrożenia schematów postępowania uwzględniających ich charakterystykę i oddalenie od pracowni hemodynamiki.
Wprowadzenie
Nadal nie ma zgodności co do tego, jaka jest optymalna strategia leczenia chorego z zawałem serca przebiegającym z uniesieniem odcinka ST (STEMI), który trafia do szpitala niedysponującego możliwością wykonania przezskórnej angioplastyki wieńcowej (PCI), a spodziewane opóźnienie zabiegu w razie decyzji o transporcie do innego ośrodka przekracza 90 minut. Jest to częsta sytuacja kliniczna, której nie oceniano bezpośrednio w żadnym badaniu klinicznym z randomizacją. W artykule omówiono możliwe opcje postępowania na podstawie analizy wyników najnowszych badań klinicznych i rejestrów.
Opis przypadku
51-letniego mężczyznę, bez choroby serca w wywiadzie, o 1.30 w nocy obudził nagły zamostkowy ból w klatce piersiowej. Samodzielnie prowadząc samochód, dojechał on do miejscowego szpitala w małym miasteczku w stanie Minnesota, oddalonego o 120 mil (ok. 190 km) od najbliższego szpitala, w którym można wykonać pierwotną przez-skórną angioplastykę wieńcową (pPCI). Mężczyzna do oddziału ratunkowego dotarł o 2.30 nad ranem, o 2.35 wykonano 12-odprowadzeniowy elektrokardiogram (EKG), w którym zaobserwowano uniesienia odcinka ST w odprowadzeniach przedsercowych typowe dla ostrego zawału typu STEMI ściany przednio-bocznej (ryc. 1). Jakie są możliwości leczenia u tego chorego?
- Podanie leku fibrynolitycznego w dawce standardowej i przyjęcie do szpitala, w którym nie jest możliwe przeprowadzenie pierwotnej przez-skórnej angioplastyki wieńcowej. W razie nieskuteczności reperfuzji przekazanie chorego do ośrodka wykonującego PCI w trybie pilnym.
- Podanie leku fibrynolitycznego w dawce standardowej, a następnie rutynowo przekazanie do ośrodka wykonującego PCI i wykonanie ratunkowej angioplastyki w razie nieskutecznej reperfuzji.
- Torowana pierwotna przezskórna angioplastyka: podanie leku fibrynolitycznego w standardowej lub zredukowanej dawce, leku antyagregacyjnego, a następnie przekazanie do ośrodka referencyjnego w celu natychmiastowej pPCI.
- Hybrydowa rewaskularyzacja farmakologiczno-interwencyjna: podanie leku fibrynolitycznego w standardowej lub zredukowanej dawce, leku antyagregacyjnego, a następnie przekazanie do ośrodka referencyjnego w celu przeprowadzenia rutynowej, ale opóźnionej pierwotnej przezskórnej angioplastyki wieńcowej (w czasie 3-24 godzin).
- Transport do ośrodka referencyjnego w celu wykonania pierwotnej przezskórnej angioplastyki wieńcowej, niezależnie od czasu jego trwania.
- Konsultacja z kardiologiem w sprawie wyboru metody postępowania.
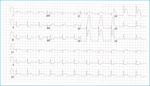
Rycina 1. Elektrokardiogram 51-letniego mężczyzny, który zgłosił się z bólem w klatce piersiowej do szpitala oddalonego o ok. 190 km od ośrodka wykonującego przezskórną angioplastykę wieńcową
Pierwotna przezskórna angioplastyka wieńcowa to optymalny sposób leczenia reperfuzyjnego u chorych z zawałem serca przebiegającym z uniesieniem odcinka ST, którzy trafiają do szpitali z pracownią hemodynamiki.1 W USA możliwość wykonania tego zabiegu ma zaledwie 25% wszystkich szpitali.2,3 Choć istnieje sprawdzona metoda selekcji chorych, podobna do systemów funkcjonujących w przypadkach urazów, dzięki której karetki omijają szpitale, w których nie można wykonać pierwotnej przezskórnej angioplastyki wieńcowej, tylko ok. 50% pacjentów z zawałem serca z uniesieniem odcinka ST zwraca się o pomoc do medycznych służb ratunkowych (pogotowie).4-6 Wykazano, że w porównaniu z leczeniem fibrynolitycznym w szpitalu bez możliwości wykonania pierwotnej przezskórnej angioplastyki wieńcowej przewiezienie chorego do ośrodka referencyjnego i wykonanie tam zabiegu poprawia wyniki leczenia.7 Aktualne wytyczne postępowania zalecają, by całkowity czas od przybycia do szpitala do rozprężenia balonu (czas drzwi–balon) był krótszy niż 90 minut, co może być trudne w przypadku pacjentów przewożonych z jednego szpitala do drugiego. Jak wynika z najnowszych amerykańskich danych, w przypadku transportowanych pacjentów średni czas od przybycia do szpitala do rozprężenia balonu wynosi 180 minut (mediana), niecałe 15% osób jest leczonych przed upływem 120 minut, natomiast przed upływem 90 minut, a więc zgodnie z obowiązującymi wytycznymi, zaledwie 4% chorych.8 W wielu sytuacjach szybki transport chorych z zawałem serca przebiegającym z uniesieniem odcinka ST jest niemożliwy ze względu na dużą odległość między ośrodkami, niekorzystne warunki pogodowe czy opóźnienia w samym systemie opieki zdrowotnej. Opóźnienia wynikające z transportu mogą niwelować korzyści z pierwotnej przezskórnej angioplastyki wieńcowej w porównaniu z leczeniem fibrynolitycznym.9 Wybór najlepszej strategii postępowania w takich przypadkach nadal budzi kontrowersje.
Na ile ważny jest czas do reperfuzji?
Reimer i wsp.10 w 1977 r. jako pierwsi opisali zjawisko czoła fali występujące w odniesieniu do niedokrwiennej martwicy komórek u psów. Udokumentowali postępowanie martwicy miokardium w czasie i możliwość zachowania żywotnego mięśnia sercowego do 3-6 godzin od zamknięcia tętnicy wieńcowej. U ludzi rozległość zawału lewej komory oceniana za pomocą tomografii emisyjnej pojedynczych fotonów (SPECT – single photon emission computed tomography) w okresie pierwszych 3-4 godzin zależy od czasu, jaki minął od wystąpienia dolegliwości do chwili rozprężenia balonu.11 Badania kliniczne nad leczeniem fibrynolitycznym12,13 i pierwotną przezskórną angioplastyką wieńcową9,14-18 wykazały ponadto nieliniową redukcję umieralności całkowitej w czasie u chorych leczonych w ciągu pierwszych 6 godzin od wystąpienia objawów. Przerwanie rozwoju zawału opisano u chorych ze STEMI, którzy otrzymali leczenie fibrynolityczne w ciągu 1-3 godzin od początku wystąpienia objawów.19
Wydaje się, że korzyści z reperfuzji są rezultatem mechanizmów zarówno zależnych, jak i niezależnych od czasu trwania niedokrwienia.20 Mechanizm zależny od czasu jest wynikiem ocalenia przed martwicą kolejnych kardiomiocytów i funkcjonuje do 6 godzin od wystąpienia objawów. Wspomniany przedział czasowy bywa bardzo różny u poszczególnych chorych. Wynika to z występowania przemijających faz niedrożności naczynia, obecności krążenia obocznego, hartowania przez niedokrwienie i czynników wpływających na wielkość zapotrzebowania tlenowego mięśnia sercowego. Niezależny od czasu mechanizm korzystnego efektu reperfuzji, wynikający z udrożnienia tętnicy i pozytywnego wpływu ukrwienia na przebudowę miokardium oraz zapewnienia krążenia obocznego, może się utrzymywać do 24-48 godzin.21 Skuteczne leczenie reperfuzyjne w tym okresie również daje szanse na zmniejszenie umieralności, ale zdecydowanie nie jest tak istotne jak w ciągu pierwszych 3-6 godzin.
Pierwsze badania kliniczne nad fibrynolizą wykazały wyraźną zależność między umieralnością w przebiegu zawału serca a czasem do podjęcia leczenia.13 Zależność umieralności od czasu do przeprowadzenia reperfuzji wydaje się istotniejsza w leczeniu fibrynolitycznym niż pierwotnej przezskórnej angioplastyce wieńcowej, choć także w przypadku tego zabiegu ma znaczenie. W badaniu Global Use of Strategies to Open Occluded Coronary Arteries-IIb (GUSTO IIb) u chorych z zawałem serca z uniesieniem odcinka ST poddawanych pierwotnej przezskórnej angioplastyce wydłużenie czasu od przybycia do szpitala do rozprężenia balonu korelowało ze wzrostem umieralności.14 Analiza danych z National Registry of Myocardial Infarction 2 (NRMI-2) wykazała, że wydłużenie czasu od wystąpienia objawów do rozprężenia balonu nie wiązało się z istotnym wzrostem umieralności wewnątrzszpitalnej, przy czym czas ten korelował ze znamiennym wzrostem umieralności skorygowanej względem wysokości ryzyka w okresie przekraczającym 2 godziny.15 W omawianym retrospektywnym rejestrze, obejmującym łącznie 661 szpitali lokalnych i referencyjnych, najkrótszy czas od wystąpienia objawów do rozprężenia balonu uzyskiwano w największych szpitalach, dlatego według niektórych parametr ten jest przede wszystkim odzwierciedleniem jakości leczenia. De Luca i wsp.9 zdołali jednak wykazać liniową zależność między czasem od wystąpienia objawów do leczenia reperfuzyjnego a umieralnością w pierwszym roku. Według nich opóźnienie wdrożenia terapii o każde 30 minut przekłada się na 7,5% wzrost umieralności rocznie.9 Wyniki analizy nowszych danych z NRMI-3 i NRMI-4, obejmujących 29 222 chorych leczonych w latach 1999-2002, wskazują, że wydłużenie czasu drzwi–balon wiąże się ze wzrostem umieralności wewnątrzszpitalnej niezależnie od czasu, jaki upływa od wystąpienia objawów do przyjęcia do szpitala, oraz występowania czynników wysokiego ryzyka (ryc. 2).22
W innych badaniach wykazano z kolei, że długość czasu od pojawienia się objawów do reperfuzji za pomocą pierwotnej przez-skórnej angioplastyki wieńcowej wpływa na umieralność tylko u chorych z grupy wysokiego ryzyka i zawałem przedniej ściany, częstością rytmu serca przy przyjęciu >100/min, ciśnieniem tętniczym <100 mmHg oraz u osób w podeszłym wieku.16,17 Brodie i wsp.,23 autorzy dużego prospektywnego rejestru jednoośrodkowego, podają, że dłuższy czas od przybycia do szpitala do rozprężenia balonu (≥2 h w porównaniu z <2 h) wiąże się z większą umieralnością wewnątrzszpitalną oraz późną (do 7 lat). Zależność ta była znamienna statystycznie tylko u chorych z grupy wysokiego ryzyka i u osób z objawami trwającymi <3 godziny.
Powyższe wyniki wskazują, że czas do reperfuzji największe znaczenie ma u chorych z grupy wysokiego ryzyka oraz u tych, którzy trafiają do szpitala w ciągu pierwszych 3 godzin od wystąpienia objawów niedokrwienia. Jak wpłynie to na nasze decyzje dotyczące chorego z zawałem serca z uniesieniem odcinka ST, który trafił do szpitala bez możliwości odpowiednio szybkiego wykonania pierwotnej angioplastyki wieńcowej? Czy dysponujemy danymi z badań klinicznych przemawiającymi za wyborem którejś z wymienionych wcześniej opcji postępowania?
Transport chorych ze STEMI w celu wykonania pPCI
W wielu kontrolowanych badaniach klinicznych przeprowadzonych z randomizacją, m.in. Primary Angioplasty After Transport of Patients from General Community Hospitals to Catheterization Units With/Without Emergency Thrombolysis Infusion (PRAGUE-2) z Czech i Danish Multicenter Randomized Trial on Thrombolytic Therapy Versus Acute Coronary Angioplasty in Myocardial Infarction (DANAMI-2) z Danii, wykazano, że transport chorego w celu wykonania pierwotnej przezskórnej angioplastyki wieńcowej jest korzystniejszy niż leczenie fibrynolityczne w szpitalu, gdzie nie można przeprowadzić takiego zabiegu.
W badaniu PRAGUE-2 850 chorych z zawałem serca z uniesieniem odcinka ST trafiających do szpitali rejonowych bez pracowni hemodynamicznych losowo przydzielono do grupy leczenia streptokinazą lub bezzwłocznego przekazania do ośrodków referencyjnych i wykonania tam pierwotnej przezskórnej angioplastyki wieńcowej.24 Pierwszorzędowym parametrem oceny końcowej była umieralność w okresie pierwszych 30 dni, maksymalna odległość między ośrodkami wynosiła 120 km. W analizie według intencji leczenia odnotowano zmniejszenie umieralności w grupie chorych przewożonych w celu wykonania pierwotnej angioplastyki wieńcowej (6,8% vs 10,0%; p=0,12). W grupie 360 chorych poddanych zabiegowi wyniosła jednak 6,0%, czyli mniej niż w grupie leczonych fibrynolitycznie (10,4%, p <0,05). Analiza podgrup wykazała brak różnic w umieralności u chorych, w przypadku których przeprowadzono randomizację w czasie <3 godzin od początku objawów, oraz istotne zmniejszenie umieralności w podgrupie pacjentów, w której randomizacja odbyła się po upływie >3 godzin, poddanych pierwotnej przezskórnej angioplastyce wieńcowej po przewiezieniu do ośrodka referencyjnego (6,0% vs 15,3% w grupie fibrynolizy; p <0,02).

Rycina 2. Umieralność wewnątrzszpitalna w zależności od czasu przybycia do szpitala do rozprężenia balonu u chorych z podziałem na grupy z uwzględnieniem czasu od wystąpienia objawów do przekroczenia drzwi szpitala. (Za McNamara i wsp.;22 za zgodą)
W badaniu DANAMI-2 wzięło udział 1572 chorych z zawałem serca przebiegającym z uniesieniem odcinka ST, którzy trafiali zarówno do ośrodków z pracownią hemodynamiki, jak i szpitali rejonowych. Zgodnie z zasadami randomizacji przydzielano ich do leczenia za pomocą tkankowego aktywatora plazminogenu (tPA) podawanego w chwili rozpoznania albo do zabiegu pierwotnej angioplastyki.25