Zapalenie opon mózgowych
Zapalenie opon mózgowych o etiologii S. aureus może być wynikiem bakteriemii wywołanej przez tę bakterię, na ogół w kontekście choroby rozsianej.17 U chorych z bakteriemią S. aureus, u których stwierdza się bóle głowy, sztywność karku lub odczyn oponowy, należy wykonać punkcję lędźwiową.
Czynniki wirulentne Staphylococcus aureus
Patogenność S. aureus wiąże się z dużą liczbą czynników wirulentnych obejmujących składniki bakterii, takie jak molekuły powierzchniowe. S. aureus wytwarza także wiele cząsteczek sekrecyjnych, w tym superantygeny (wiążą się bezpośrednio z głównym układem zgodności tkankowej MHC klasy II i pobudzają nie tylko jeden klon limfocytów swoiście rozpoznających antygen, lecz wszystkie limfocyty mające daną odmianę łańcucha Vβ – przyp. red.), cytotoksyny, takie jak leukocydyna Pantona–Valentine’a, oraz enzymy.
Zespół wstrząsu toksycznego
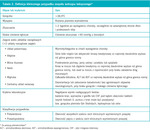
Zespół wstrząsu toksycznego to ciężka choroba, która może prowadzić do zgonu. Wykazuje wiele charakterystycznych cech laboratoryjnych i w obrazie klinicznym (tab. 2).18 Częściej rozwija się z miejsca kolonizacji niż z zakażenia i wiąże się z wytwarzaniem egzotoksyn.19 We wczesnych latach 80. minionego wieku w Ameryce Północnej zgłoszono wiele przypadków tej choroby związanych ze stosowaniem superchłonnych tamponów. Do dziś w wyniku edukacji pacjentów i zmian w składzie tamponów odsetek przypadków zespołu wstrząsu toksycznego związanych z menstruacją zmalał.20 Poza menstruacją do rozwoju choroby może dojść wskutek zakażeń miejscowych, zabiegu chirurgicznego lub ukąszenia owadów. Umieralność związana z zespołem wstrząsu toksycznego, do którego doszło w wyniku zakażenia gronkowcem, wynosi ok. 5%.
Pozaszpitalne zakażenia metycylinoopornym Staphylococcus aureus
Do zakażenia metycylinoopornym S. aureus (MRSA – methicillin-resistant ‘S. aureus’) na ogół dochodzi w trakcie pobytu pacjenta w szpitalu lub innych instytucjach służby zdrowia. Zakażenia takie określa się mianem szpitalnych MRSA (HA-MRSA – hospital-associated MRSA).21 Ostatnio jednak coraz większy problem, szczególnie w USA, stanowią pozaszpitalne zakażenia MRSA (CA-MRSA – community associated MRSA). Szczepy te różnią się genotypem i fenotypem od tych wywołujących HA-MRSA. Szczepy pozaszpitalne często są wrażliwe na większą liczbę leków przeciwbakteryjnych, w tym cyprofloksacynę, i są zbliżone do pozaszpitalnych szczepów S. aureus wrażliwych na metycylinę (MSSA – methicillin-sensitive ‘S. aureus’). Większość z nich wytwarza toksynę – leukocydynę Pantona–Valentine’a.22
Leukocydyna Pantona–Valentine’a
Toksyna leukocydyna Pantona–Valentine’a (PVL – Panton–Valentine leucocidin), po raz pierwszy opisana w 1932 r., jest kodowana przez mobilnego faga zawierającego geny kodujące dwa produkty, które następnie łączą się ze sobą w kompleks zdolny do perforacji błony komórkowej, który niszczy białe krwinki i prowadzi do martwicy tkanek.23 Choroby wywołane przez leukocydynę Pantona–Valentine’a, często związane z ciężkimi zakażeniami, w tym z martwiczym zapaleniem płuc,24 nie są nowym zjawiskiem.
W Wielkiej Brytanii i na całym świecie w związku z występowaniem w Stanach Zjednoczonych ognisk zachorowań wywołanych pozaszpitalnym MRSA rośnie zainteresowanie chorobą związaną z obecnością leukocydyny Pantona–Valentine’a. Obecnie w Wielkiej Brytanii choroba związana z tą toksyną najczęściej wiąże się z zakażeniem MSSA. Choć do dziś w Wielkiej Brytanii zarejestrowano tylko nieliczne ogniska MRSA, należy zachować ostrożność na wypadek wzrostu liczby tych zakażeń. Znane czynniki ryzyka zakażenia PVL S. aureus przedstawiono w tabeli 3.25

Tabela 4. Cechy kliniczne choroby związanej z leukocydyną Pantona–Valentine’a (PVL) Staphylococcus aureus*
Dochodzenie dotyczące choroby związanej z leukocydyną Pantona–Valentine’a w Wielkiej Brytanii doprowadziło do ujawnienia licznych ośrodków, w których do zachorowań dochodziło ze znacznie większą częstotliwością. Zaowocowało to opracowaniem przez Department of Health tymczasowych zaleceń dotyczących postępowania w takich przypadkach.26 Rozpoznanie choroby związanej z leukocydyną Pantona–Valentine’a na podstawie objawów klinicznych jest ważne, ponieważ do jej leczenia zaleca się stosowanie swoistych schematów terapeutycznych i metod prowadzących do eradykacji bakterii. Cechy kliniczne wskazujące na występowanie PVL S. aureus podano w tabeli 4.
Zakażenia skóry i tkanek miękkich
Większość zakażeń skóry i tkanek miękkich można leczyć ambulatoryjnie za pomocą doustnych leków przeciwbakteryjnych. Zawsze gdy to możliwe, lek należy wybrać na podstawie wyniku posiewu określającego wrażliwość bakterii na leki tej grupy. W przypadku ciężkiej postaci choroby należy szybko podać leki przeciwbakteryjne pozajelitowo. Obecne zalecenia rekomendują terapię łączącą leczenie klindamycyną podawaną dożylnie oraz linezolidem w celu supresji produkcji PVL i toksyn α z ryfampicyną, którą stosuje się do eradykacji gronkowca. Na oddziałach intensywnej terapii należy rozważyć podanie dożylnych immunoglobin, ponieważ neutralizują one egzotoksyny i superantygeny.
Staphylococcus aureus częściowo i całkowicie oporny na wankomycynę
Szczepy S. aureus o ograniczonej wrażliwości na wankomycynę po raz pierwszy opisano w Japonii w 1997 r. Izolaty zawierające te bakterie nie reagują dobrze na terapię glikopeptydami i nie są wykrywane w rutynowych testach mikrobiologicznych. Mechanizm oporności nie jest jasny, ale prawdopodobnie wiąże się z wytwarzaniem przez mikroorganizmy grubszej otoczki. Zakażenie VISA należy podejrzewać u każdego chorego z zakażeniem S. aureus utrzymującym się mimo przedłużonego leczenia glikopeptydami. W takich przypadkach izolaty należy przekazać do laboratorium referencyjnego do badań specjalistycznych. Zgłaszano też zakażenia izolatami całkowicie opornymi na wankomycynę, ale są one rzadkie.