Natalizumab jest lekiem najczęściej stosowanym wśród chorych z wysoką aktywnością SM. W badaniu Vukusic i wsp. podkreślono trudności w planowaniu ciąży w tej grupie pacjentek, wskazując na wzrost rocznego wskaźnika rzutów z 0,4 ±0,6 podczas leczenia natalizumabem do 1,8 ±0,7 w okresie od odstawienia leku do zapłodnienia. W grupie tej, liczącej 6 kobiet, obserwowano również zwiększoną aktywność choroby w trakcie ciąży. Z tego powodu zadecydowano o szybkim włączeniu leku po porodzie (średnio po 7,8 dnia) i uzyskano całkowite ustąpienie rzutów choroby u 5 pacjentek w okresie obserwacji wynoszącym 14,2 ±9,1 miesiąca. Tym samym potwierdzono, że włączenie natalizumabu bezpośrednio po porodzie wpływa korzystnie na kliniczną oraz radiologiczną aktywność choroby; nie wykazano opóźnienia w rozpoczęciu działania leku, obserwowanego zarówno w przypadku interferonu β, jak i octanu glatyrameru.5
Z kolei badanie przeprowadzone przez Haghikię i wsp. wskazywało na możliwość zastosowania natalizumabu w czasie ciąży u kobiet z wysoką aktywnością choroby. W opracowaniu tym ekspozycja na lek w III trymestrze ciąży wiązała się jednak z wystąpieniem powikłań hematologicznych w przypadku 10 na 13 ocenianych ciąż, co potwierdziło wcześniejsze doniesienia i jednocześnie ograniczyło bezpieczeństwo stosowania natalizumabu w ciąży.42
Fingolimod
Fingolimod również zakwalifikowano do kategorii C w klasyfikacji FDA. W badaniu oceniono wpływ wewnątrzmacicznej ekspozycji na lek w I trymestrze ciąży. Z łącznej liczby 89 ciąż kompletne informacje uzyskano jedynie w przypadku 61. W grupie tej ostatecznie stwierdzono 28 żywych urodzeń, 9 samoistnych poronień i aż 24 przypadki dobrowolnego usunięcia ciąży, co znacząco ograniczyło możliwość pełnej oceny badania. Wady wrodzone stwierdzono łącznie u 5 płodów. W podsumowaniu badania autorzy zwrócili uwagę na przeciwwskazania do przyjmowania leku przez kobiety w wieku rozrodczym.43 Dostępne dane wskazują również na konieczność stosowania antykoncepcji przez okres 2 miesięcy od zakończenia przyjmowania fingolimodu i rozpoczęcie starań o poczęcie dziecka po tym czasie.38
Teryflunomid
Teryflunomid jako jedyny lek immunomodulacyjny został zakwalifikowany do kategorii X w klasyfikacji FDA, co było konsekwencją wykazania jego teratogennego działania w badaniach na zwierzętach. Lek jest bezwzględnie przeciwwskazany u kobiet planujących macierzyństwo. Po zakończeniu terapii tym preparatem konieczne jest stosowanie antykoncepcji, dopóki jego stężenie w surowicy wynosi >0,2 mg/l. W przypadku potwierdzenia ciąży przy wyższym stężeniu teryflunomidu w surowicy lub podczas jego przyjmowania trzeba wdrożyć metody przyspieszonej eliminacji.38 Dostępne dane dotyczące konsekwencji wewnątrzmacicznej ekspozycji ludzkich płodów na lek są ograniczone, choć nie wskazują na jego teratogenność.44
Fumaran dimetylu
Fumaran dimetylu zakwalifikowano do kategorii C w klasyfikacji FDA. Dane oceniające wpływ wewnątrzmacicznej ekspozycji ludzkich płodów na lek są ograniczone odpowiednio do 39 i 28 ciąż. Grupy te różniły się znacząco pod względem odsetka samoistnych poronień (8% vs 46%).45 Z tego powodu zaleca się, aby kobiety z SM planujące ciążę unikały fumaranu dimetylu.
Alemtuzumab
Alemtuzumab, będący przeciwciałem monoklonalnym IgG1, także zakwalifikowano do kategorii C w klasyfikacji FDA. Dane dotyczące ekspozycji na lek w czasie ciąży są ograniczone i nie wskazują na zwiększone ryzyko samoistnych poronień lub urodzenia martwego dziecka.46 Z powodu długiego okresu półtrwania leku zaleca się zajście w ciążę po 4 miesiącach od zakończenia leczenia, a w przypadku potwierdzenia ciąży po podaniu pierwszej dawki bezpieczne wznowienie terapii jest możliwe dopiero po porodzie.38
Mitoksantron
Mitoksantron jest antybiotykiem antracyklinowym należącym do kategorii D w klasyfikacji FDA. Z uwagi na mechanizm działania (inhibicja topoizomerazy II) ma toksyczny wpływ na kwas deoksyrybonukleinowy. Z tego powodu kobietom z SM zaleca się planowanie ciąży dopiero po 6 miesiącach od zakończenia leczenia.38 Mitoksantron jest jedynym lekiem modyfikującym przebieg SM, który wpływa na płodność leczonych nim kobiet i mężczyzn.
Dane dotyczące wpływu wewnątrzmacicznej ekspozycji ludzkich płodów na lek są ograniczone do opisów pojedynczych przypadków. W jednym opracowaniu odnotowano niższą masę i długość urodzeniową dziecka, ale bez dowodów na istnienie wad wrodzonych pomimo ekspozycji na lek w czasie całej ciąży.47 W drugim doniesieniu stwierdzono zespół Pierre’a Robina u noworodka matki, która była leczona mitoksantronem w okresie okołokoncepcyjnym.48
Okres poporodowy
Karmienie piersią wpływa korzystnie na aktywność SM u kobiet w okresie poporodowym, choć jego działanie na przebieg choroby jest niewielkie. Szczególnie wyraźnie te pozytywne efekty widać w przypadku niestosowania innych form dokarmiania dzieci. Z tego powodu rekomenduje się wyłączne karmienie piersią przez pierwsze 4-6 miesięcy po porodzie przez kobiety, które nie zdecydowały się na wznowienie leczenia immunomodulacyjnego.18 Ochronny wpływ karmienia piersią na przebieg SM wynika prawdopodobnie z podwyższonego stężenia prolaktyny, która zwiększała zdolność remielinizacji w badaniach eksperymentalnych.49
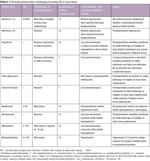
Kobietom karmiącym nie zaleca się stosowania żadnego z dostępnych leków modyfikujących przebieg SM. Wznowienie karmienia piersią powinno nastąpić po 4 miesiącach od zaprzestania leczenia alemtuzumabem i po 28 dniach od zakończenia leczenia mitoksantronem.38 W tabeli 2 przedstawiono aktualny stan wiedzy na temat profilu bezpieczeństwa leków modyfikujących przebieg SM w czasie laktacji. W przypadku wysokiej poporodowej aktywności choroby należy zakończyć karmienie piersią i wdrożyć leczenie immunomodulacyjne. Z uwagi na szybki początek działania i wysoką skuteczność w redukcji aktywności SM warto rozważyć w tym wskazaniu także natalizumab.42
Podsumowanie
Ciążę należy traktować jako stan fizjologiczny modyfikujący przebieg SM. Kobiety z rozpoznanym SM planujące macierzyństwo powinny unikać leków o udowodnionym działaniu teratogennym. W przypadku pacjentek z wysoką aktywnością choroby leczenie immunomodulacyjne powinno być prowadzone do momentu uzyskania pozytywnego wyniku testu ciążowego. Najkorzystniejszy profil bezpieczeństwa wykazuje w tym okresie octan glatyrameru, choć dopuszcza się również możliwość podawania preparatów interferonu β. Pojedyncze doniesienia wskazują na możliwość bezpiecznego kontynuowania leczenia natalizumabem do momentu potwierdzenia ciąży w grupie kobiet już leczonych. W wybranych przypadkach pacjentek z wysoką aktywnością choroby dopuszczalne jest przyjmowanie octanu glatyrameru w czasie ciąży.
Po porodzie nie zaleca się jednoczesnego karmienia piersią oraz stosowania leków immunomodulacyjnych. W przypadku wysokiej poporodowej aktywności choroby rekomenduje się zaprzestanie karmienia piersią i wdrożenie leczenia immunomodulacyjnego. Z uwagi na szybki początek działania warto rozważyć w tym wskazaniu terapię natalizumabem u wybranych kobiet.