Spośród 111 chorych z korzystnym rokowaniem u 98 wykonano po operacji rezonans magnetyczny (MRI) w celu oceny doszczętności zabiegu. Pomimo że w protokołach pooperacyjnych zabieg uznawano za całkowicie radykalny (resekcja R0), to badanie MRI w sekwencji T2 w 58 tych przypadkach (59 proc.) wykazało obecność choroby resztkowej < 1 cm, u 31 chorych (32 proc.) zmianę resztkową 1-2 cm i u dziewięciu chorych (9 proc.) zmianę > 2 cm. Wielkość zmiany resztkowej skorelowana była z progresją. Nawroty rozpoznawano u 26 proc. chorych ze zmianą resztkową > 1 cm, u 68 proc. chorych ze zmianą resztkową wielkości 1-2 cm oraz w 89 proc. przypadków guza resztkowego > 2 cm. Według autorów badania u chorych w grupie korzystnego rokowania, u których guz wyjściowo miał wymiar > 4 cm, lub ze zmianą resztkową > 1 cm, lub z rozpoznaniem histopatologicznym gwiaździaka, lub z deficytami neurologicznymi (z wyłączeniem napadów padaczkowych), określanych jako grupa wysokiego ryzyka, po całkowitej makroskopowej resekcji guza należy rozważyć zastosowanie leczenia adiuwantowego.
Wstępne wyniki badania zostały opublikowane w 2012 roku (średni czas obserwacji wynosił 5,9 roku). Autorzy zidentyfikowali trzy czynniki predykcyjne gorszego OS:
- przedoperacyjna średnica guza większa niż 4 cm,
- histologiczne rozpoznanie gwiaździaka lub glejaka mieszanego,
- oceniane w MRI pooperacyjne zmiany resztkowe > 1 cm.
Ponadto stwierdzono, że dodanie chemioterapii PCV istotnie wydłużyło PFS w porównaniu z samodzielną radioterapią, pozostając bez wpływu na OS. Hematologiczna toksyczność 3 i 4 stopnia wystąpiła odpowiednio u 8 i 3 proc. chorych w grupie z wyłączną radioterapią w porównaniu z 51 i 15 proc. w grupie z radioterapią w połączeniu z chemioterapią PCV.[5]
W 2014 roku opublikowano ponowną analizę badania RTOG 9802. Średni czas obserwacji wynosił wówczas 11,9 roku, zmarło 55 proc. objętych badaniem chorych. PFS w grupie z radioterapią i chemioterapią PCV wyniósł 10,4 roku, a w grupie z samodzielną radioterapią były to cztery lata. OS także było lepsze w grupie z radioterapią i chemioterapią PCV i wynosiło 13,3 roku w porównaniu z samodzielną radioterapią, gdzie było to siedem-osiem lat.[7]
Badanie RTOG 9802, choć nie odnosi się do roli chemioterapii jako wyłącznego leczenia uzupełniającego, to jednak wskazuje, którzy pacjenci mogą wymagać adiuwantowej chemioterapii w pierwszej linii. Ponadto w tym badaniu potwierdzono, że status resekcji guza przed podjęciem decyzji o pooperacyjnym planie leczenia zawsze powinien być weryfikowany w pooperacyjnym badaniu MRI.
Inne badania
Badanie RTOG 9802 było poprzedzone przez badanie RTOG 9402, w którym także porównano tolerancję samodzielnej radioterapii z tolerancją radioterapii z chemioterapią PCV, i wykazano dużo gorszą tolerancję leczenia skojarzonego. W badaniu RTOG 9402 tylko 48 proc. chorych randomizowanych do ramienia z chemioterapią PCV zdołało ukończyć wszystkie cztery zaplanowane kursy chemioterapii.[6]
W innym badaniu Labrun i wsp. dokonali retrospektywnej analizy 33 przypadków chorych na LGG po częściowej resekcji guza z następczą chemioterapią.[8] U chorych stosowano chemioterapię PCV (sześć cykli). W żadnym przypadku nie stosowano radioterapii. Leczenie uzupełniające rozpoczynano średnio dwa miesiące po zabiegu chirurgicznym. PFS wynosił ponad 30 miesięcy, a OS oceniony po dwóch i pięciu latach wynosił odpowiednio 85 i 75 proc. Odpowiedź kliniczną zdefiniowaną jako zmniejszenie częstości napadów drgawkowych odnotowano u 81 proc. chorych. Z badania wynika, że chemioterapia PCV przedłuża PFS i pozwala odroczyć radioterapię oraz że zastosowanie adiuwantowej chemioterapii PCV może być wykorzystywane u chorych na LGG, którzy prezentują objawy neurologiczne.
Kolejne prospektywne nierandomizowane badanie oceniające skuteczność chemioterapii PCV u chorych z LGG przedstawił Buckner i wsp.[9] Grupę badaną stanowiło 28 chorych, którzy zostali poddani biopsji lub subtotalnej resekcji guza. Chemioterapię PCV (sześć cykli w ośmiotygodniowych odstępach) rozpoczynano 3-12 tygodni po zabiegu operacyjnym. U 26 chorych dodatkowo zastosowano radioterapię. W kontrolnym badaniu MRI wykazano obiektywną odpowiedź u ośmiu chorych, stabilizację choroby u 17 chorych i progresję nowotworu w trzech przypadkach. Autorzy zaobserwowali wysoką toksyczność leczenia; u 75 proc. chorych wystąpiła neutropenia III i IV stopnia, u 64 proc. chorych stwierdzono trombocytopenię III stopnia, jednocześnie odnotowano wysoki odsetek neurotoksyczności.
W następnym retrospektywnym badaniu Frenay i wsp. przedstawili analizę przebiegu leczenia 10 chorych leczonych w ich ośrodku, gdzie oceniano wpływ chemioterapii na kontrolę objawów w przypadkach LGG.[10] U chorych rozpoznano nieoperacyjnego gwiaździaka fibrylarnego. Wszyscy chorzy przed rozpoczęciem chemioterapii mieli wykonaną biopsję guza, żaden z nich nie otrzymywał radioterapii. Chemioterapię PCV rozpoczęto dwa-cztery miesiące po biopsji. Średni czas obserwacji wyniósł sześć i pół roku. U wszystkich chorych obserwowano poprawę afazji, u czterech chorych nastąpiła kontrola napadów padaczkowych, a zmniejszenie częstości tych napadów dotyczyło trzech chorych. Autorzy badania w podsumowaniu stwierdzili, że u chorych z oporną na leczenie padaczką, spowodowaną nieoperacyjnym LGG, chemioterapia PCV może poprawić stan neurologiczny i umożliwić odroczenie radioterapii.
Nowe podejście do leczenia LGG: rola temozolomidu
Doustny lek o działaniu alkilującym temozolomid (TMZ) jest wykorzystywany z powodzeniem w pierwszej linii leczenia glejaków WHO IV.[11] Działania niepożądane jego stosowania są lepiej tolerowane przez chorych niż w przypadku PCV, co coraz silniej skłania badaczy do zastosowania TMZ w glejakach WHO II.
Zasadność takiego postępowania mogą potwierdzać wyniki badania RTOG 0424, obejmującego 136 chorych, w którym porównano zastosowanie radiochemioterapii TMZ do historycznej grupy kontrolnej, składającej się z chorych wysokiego ryzyka uczestniczących w badaniach EORTC 22845 i EORTC 22844 leczonych samodzielną radioterapią. Wstępne wyniki badania potwierdziły istotnie wyższe trzyletnie OS po wydłużonym schemacie TMZ w porównaniu z grupą kontrolną chorych z grupy wysokiego ryzyka LGG. Należy jednak zauważyć, że porównywane grupy wysokiego ryzyka różniły się i zawierały chorych spełniających inne kryteria.[12,17-19]
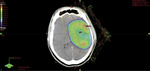
Ryc. 3. Układ pól i rozkład dawki u chorego po subtotalnej resekcji glejaka WHO II w trakcie radioterapii.
Kolejne obserwacje przedstawił Ricard i wsp., którzy oceniali progresję glejaków wysoko zróżnicowanych oraz wpływ TMZ na zmiany średnicy guza.[13] Autorzy poddali ocenie średnicę guza przed leczeniem, podczas i po leczeniu TMZ w grupie 107 chorych. Pomiaru dokonywano na podstawie badania MRI. Jako pełną odpowiedź definiowano brak obecności guzów w sekwencjach T2 w badaniu MRI lub w sekwencji FLAIR (ryc. 1-3). Odpowiedź częściową definiowano jako redukcję ponad 50 proc. wielkości guza, natomiast mierną odpowiedź definiowano jako zmniejszenie o 25-50 proc. masy guza. Progresję choroby definiowano jako wzrost powyżej 25 proc. wielkości guza. W badanej grupie 20 chorych osiągnęło częściową odpowiedź radiologiczną, u 45 chorych stwierdzono mierną odpowiedź, u 35 chorych rozpoznano stabilizację kliniczną, natomiast w siedmiu przypadkach doszło do progresji nowotworu. Poprawę kliniczną zaobserwowano u 68 chorych (63,5 proc.), w 34 przypadkach (31,8 proc.) wykazano stabilizację kliniczną i u pięciu chorych doszło do progresji choroby. Ryzyko progresji było znamiennie wyższe u chorych bez kodelecji 1p/19q (60,6 v. 16,6%; p < 0,0004).
W innym badaniu Sherman i jego wsp. ocenili wpływ TMZ na częstość napadów padaczkowych u chorych z LGG.[14] Była to retrospektywna ocena 69 chorych, u których występowały napady padaczkowe. Porównano grupę 39 chorych, którzy po leczeniu operacyjnym otrzymali TMZ, z grupą kontrolną (30 chorych), którzy byli leczeni tylko operacyjnie. U 23 chorych przyjmujących TMZ nie odnotowano napadów padaczkowych (59 proc.), natomiast w grupie kontrolnej było to 13 proc. Autorzy stwierdzili, że TMZ zmniejsza częstotliwość napadów w podgrupie chorych z LGG. Interpretacja tych wyników jest ograniczona, ponieważ brak jest danych, jak długi czas upłynął od ustalenia rozpoznania do zastosowania TMZ.