Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Choroba niedokrwienna serca
Powikłania w leczeniu interwencyjnym choroby wieńcowej
Maciej Lesiak
Wprowadzenie
Miniona dekada zaowocowała niesłychanym postępem w kardiologii, a szczególnie w kardiologii interwencyjnej. Wprowadzenie stentów uwalniających leki antyproliferacyjne (drug-eluting stents, DES) dzięki znaczącemu zmniejszeniu ryzyka nawrotu zwężenia w mechanizmie restenozy pozwoliło rozszerzyć wskazania do przezskórnych interwencji wieńcowych (percutaneous coronary intervention, PCI). Coraz więcej chorych, którzy wcześniej byli kierowani na operacje pomostowania aortalno-wieńcowego (coronary artery bypass graft, CABG) ze względu na złożoność zmian, może być obecnie leczonych interwencyjnie. Badanie SYNTAX potwierdziło, że duża część pacjentów z wielonaczyniową chorobą niedokrwienną serca lub ze zwężeniem pnia lewej tętnicy wieńcowej odnosi podobne korzyści z leczenia PCI, jak i CABG [1]. Utrzymywanie się dobrych wyników odległych po zabiegach przezskórnych w tej grupie potwierdziła niedawno opublikowana trzyletnia obserwacja z tego badania [2]. W 2010 roku w Polsce wykonano ponad 100 000 zabiegów PCI, natomiast w 2000 roku – niespełna 20 000. Z bazy danych prowadzonej przez Asocjację Interwencji Sercowo-Naczyniowych Polskiego Towarzystwa Kardiologicznego (AISN) wynika, że średnia wieku pacjentów poddawanych zabiegom PCI wzrosła z 61,5 roku w 2004 roku do 65,6 roku w 2011. Przeprowadzanie tak dużej liczby coraz trudniejszych zabiegów w starzejącej się populacji rodzi obawy o możliwy wzrost liczby powikłań okołozabiegowych i wiążących się z tym konsekwencji klinicznych.
Możliwe powikłania po PCI
Możemy wyróżnić trzy główne grupy powikłań towarzyszącym zabiegom PCI:
• powikłania sercowe,
• powikłania krwotoczne,
• powikłania związane ze stosowaniem środków kontrastowych oraz promieniowania jonizującego.
Powikłania sercowe mogą prowadzić do zgonu, zawału mięśnia sercowego lub udaru mózgu. Powikłania krwotoczne najczęściej związane są z nakłuciem tętnicy udowej, a ich konsekwencje kliniczne zależą od wielkości krwawienia. Najpoważniejszym niekorzystnym działaniem środków cieniujących jest wystąpienie pokontrastowego ostrego uszkodzenia nerek (contrast induced acute kidney injury, CIAKI).
Powikłania sercowe
Nagłe zamknięcie tętnicy wieńcowej
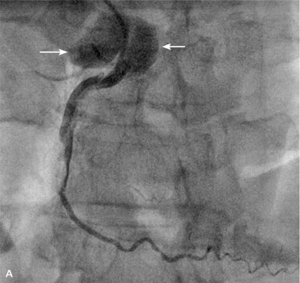
RYCINA 1. Rozwarstwienie pnia lewej tętnicy wieńcowej (strzałki) końcówką głęboko wprowadzonego cewnika.
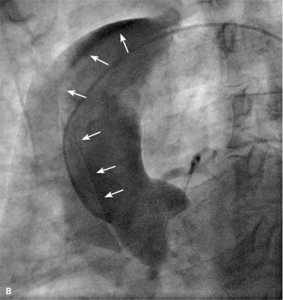
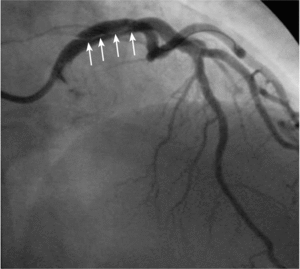
RYCINA 2. [A] Dyssekcja początkowego odcinka prawej tętnicy wieńcowej. [B] Progresja rozwarstwienia w kierunku łuku aorty.
Najczęstszym powikłaniem sercowym jest nagłe zamknięcie naczynia w czasie zabiegu lub wkrótce po nim. Dochodzi do niego zazwyczaj wskutek rozwarstwienia ściany poszerzanej tętnicy, zakrzepicy w stencie lub wystąpienia tzw. zjawiska no flow. W czasach przed upowszechnieniem się stentów dyssekcja zamykająca naczynie często prowadziła do pilnej operacji kardiochirurgicznej. Obecnie powikłanie to rzadko prowadzi do trwałej okluzji tętnicy wieńcowej z wyjątkiem tzw. dyssekcji spiralnej obejmującej bardzo długi odcinek, czasami nawet całe naczynie. Zazwyczaj implantacja jednego lub więcej stentów rozwiązuje problem. Dyssekcja może być trudna do zaopatrzenia, jeśli dojdzie do niej przed wprowadzeniem prowadnika lub gdy wprowadzenie stentu jest niemożliwe ze względu na krętość naczynia lub obecność zwapnień. Szczególnym rodzajem dyssekcji jest rozwarstwienie początkowego odcinka naczynia cewnikiem prowadzącym. Takie zdarzenie jest szczególnie niebezpieczne, jeśli dotyczy pnia lewej tętnicy wieńcowej (ryc. 1) i może się skończyć nagłym zgonem pacjenta. Czasami krew wnikająca do ściany naczynia blisko miejsca odejścia rozwarstwia opuszkę aorty. Taka dyssekcja może szybko objąć nawet całą aortę aż do jej podziału (ryc. 2A, B), co często wymaga pilnej interwencji chirurgicznej.
Drugą najczęstszą przyczyną nagłego zamknięcia naczynia jest ostra zakrzepica w stencie. Zdarza się ona częściej u pacjentów, u których zabieg wykonano ze wskazań nagłych, zazwyczaj w zawale mięśnia sercowego. Do innych ważnych czynników ryzyka należą: niewłaściwe rozprężenie stentu, implantacja w zmianę zawierającą skrzeplinę, pozostawienie dyssekcji na odcinku niepokrytym stentem, implantacja mnogich lub długich stentów, niewłaściwe przygotowanie pacjenta lekami przeciwzakrzepowymi. W przypadku wystąpienia ostrej zakrzepicy w stencie pacjenta należy natychmiast poddać zabiegowi PCI z podaniem dowieńcowo i we wlewie dożylnym inhibitora receptora płytkowego GP IIb/IIIa. W większości przypadków wystarczy wtedy plastyka balonowa i właściwe doprężenie stentu. Jeśli przyczyną zakrzepicy była dyssekcja brzeżna, należy ją pokryć dodatkowym stentem.
Ze zjawiskiem no flow mamy najczęściej do czynienia w interwencjach u pacjentów z zawałem mięśnia sercowego z uniesieniem odcinka ST (STEMI). Do innych czynników ryzyka należą zabiegi w obrębie zmian zawierających skrzeplinę oraz zlokalizowanych w zdegenerowanych żylnych pomostach aortalno-wieńcowych. Mechanizm tego zjawiska jest złożony. W zabiegach elektywnych jego przyczyną jest masywna dystalna embolizacja materiałem zakrzepowym lub fragmentami uwolnionymi z blaszki miażdżycowej. W STEMI dodatkową przyczyną jest uszkodzenie naczyń mikrokrążenia, dysfunkcja śródbłonka oraz skurcz naczyniowy. W prewencji w zabiegach na pomostach aortalno-wieńcowych stosuje się różne urządzenia protekcji dystalnej lub proksymalnej (filtry, balony okluzyjne i inne). U pacjentów ze STEMI najlepiej zapobiegać temu powikłaniu, skracając czas do zabiegu, podając leki przeciwpłytkowe oraz usuwając skrzeplinę z tętnicy odpowiedzialnej za zawał za pomocą cewnika do trombektomii aspiracyjnej. Niedawno wykazano, że stosowanie tej ostatniej metody nie tylko poprawia przepływ w leczonym naczyniu, lecz także przeżycie [3]. Pewną nadzieję budzi prewencyjne dowieńcowe podanie dużej dawki adenozyny jeszcze przed przywróceniem przepływu w tętnicy odpowiedzialnej za zawał [4].
Obecnie, bez względu na przyczynę, nagłe zamknięcie naczynia w czasie zabiegu rzadko prowadzi do poważnych konsekwencji klinicznych. W większości przypadków drożność udaje się przywrócić jeszcze w pracowni hemodynamiki technikami kardiologii interwencyjnej. Interwencja kardiochirurgiczna, która w latach 80. XX wieku była niezbędna w ok. 10% zabiegów PCI, obecnie jest konieczna w 0,1-0,4% przypadków [5,6]. W Europie od dawna nie jest wymagane zaplecze kardiochirurgiczne w miejscu wykonywania zabiegów PCI [7]. Opublikowane w roku 2011 wytyczne amerykańskie także dopuszczają możliwość wykonywania pilnych i elektywnych zabiegów PCI bez zaplecza kardiochirurgicznego na miejscu u właściwie dobranych pacjentów, w ośrodkach z dużym doświadczeniem, mających możliwości wspomagania hemodynamicznego oraz szybkiego transportu do najbliższego ośrodka kardiochirurgicznego [8]. W kierowanej przeze mnie Pracowni Hemodynamiki I Kliniki Kardiologii UM w Poznaniu, w której wykonujemy ok. 1800 zabiegów PCI rocznie, pilna interwencja kardiochirurga w ostatnich trzech latach była konieczna u trzech pacjentów.
Nagłe zamknięcie dużej tętnicy nasierdziowej, jeśli nie uda się szybko przywrócić przepływu, prowadzi zazwyczaj do zawału mięśnia sercowego. Zawał bywa rozpoznawany także po niepowikłanych zabiegach PCI. Częstość jego występowania zależy od przyjętej definicji. Wzrost stężenia biomarkerów powyżej 99 percentyla górnej granicy normy świadczy o dokonanej martwicy. Zgodnie z uniwersalną definicją przyjętą w 2007 roku przez towarzystwa europejskie i amerykańskie, za zawał mięśnia sercowego będący powikłaniem zabiegu PCI można uznać wzrost markerów przekraczający trzykrotność 99 percentyla górnej granicy normy, jeśli wyjściowo to stężenie było prawidłowe [9]. Taki jatrogenny zawał oznaczono typem 4a, w odróżnieniu od zawału wywołanego zakrzepicą w stencie (4b). Według tej definicji aż u 15% pacjentów poddawanych obecnie zabiegom PCI można rozpoznać okołozabiegowy zawał serca [10,11]. Dlatego ostatnie wytyczne amerykańskie zalecają rutynowe badanie stężenia markerów martwicy po zabiegu PCI tylko u pacjentów, u których w czasie zabiegu doszło do powikłań lub występują objawy niedokrwienia (klasa zaleceń I, poziom dowodów C). W wytycznych czytamy, że w niepowikłanych zabiegach u bezobjawowych pacjentów rutynowe oznaczanie markerów „może być uzasadnione” (klasa zaleceń IIb, poziom dowód C) [8]. Przyczyną wycieku enzymów martwicy w czasie zabiegu PCI, oprócz nagłego zamknięcia leczonego naczynia, może być przedłużające się niedokrwienie (wielokrotne, długie inflacje), zamknięcie jego odgałęzień, przemieszczenie skrzepliny lub fragmentu blaszki miażdżycowej i embolizacja drobnych naczyń na obwodzie i inne. Z danych AISN wynika, że w 2011 roku w polskich pracowniach zawał mięśnia sercowego był następstwem powikłania zabiegu PCI u 0,5% leczonych, najczęściej gdy interwencja była wykonywana w ostrym zawale mięśnia sercowego (1,7%), natomiast w zabiegach elektywnych u 0,2% chorych.
Perforacja tętnicy wieńcowej
Według klasyfikacji zaproponowanej przez Ellisa rozróżniamy trzy typy perforacji [12]:
• typ I (postać najłagodniejsza), gdy kontrast przedostaje się tylko w głąb ściany naczynia,