Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Genetyka w kardiologii
Medycyna spersonalizowana chorób układu krążenia – genomika
Tadeusz Osadnik,1 Andrzej Wiczkowski,2 Patrycja Wizińska,3 Joanna Katarzyna Strzelczyk,2 Bożena Szyguła-Jurkiewicz,1 Lech Poloński1
Wprowadzenie
W marcu 2012 r. w Kardiologii po Dyplomie ukazał się przedruk z New England Journal of Medicine niezwykle interesującego artykułu autorstwa Christophera J. O’Donnella i Elizabeth G. Nabel, w którym omówiono pojęcie genomiki i dokonano przeglądu wyników badań genetycznych i genomicznych związanych z analizą patomechanizmu różnych chorób układu krążenia [1].
W niniejszym artykule autorzy chcą ukazać rolę, jaką może odegrać genomika w indywidualizacji prewencji i terapii chorób układu krążenia.
Medycyna spersonalizowana (zindywidualizowana) zakłada dostosowanie metod prewencji i terapii do każdego chorego z uwzględnieniem wszystkich znanych cech różniących go od innych osób z daną chorobą. Obecnie indywidualizacja postępowania lekarskiego opiera się głównie na analizie czynników ryzyka wystąpienia niekorzystnych zdarzeń sercowo-naczyniowych zidentyfikowanych w badaniach obserwacyjnych i randomizowanych badaniach klinicznych. Wraz z rosnącymi osiągnięciami nauk podstawowych indywidualizacja terapii zaczyna uwzględniać także profil molekularny chorego, w skład którego wchodzą analizy DNA, RNA, białek i metabolitów. Niniejszy artykuł poświęcony jest genomice, czyli dziedzinie biologii molekularnej, której głównym obszarem zainteresowań jest analiza genomu.
Odkrycie struktury DNA przez Watsona i Cricka, identyfikacja mutacji odpowiedzialnych za wystąpienie chorób monogenowych oraz zakończenie sukcesem prac nad poznaniem sekwencji ludzkiego genomu w 2003 r. sprawiły, że indywidualizacja terapii w oparciu o profil molekularny stała się jednym z głównych celów współczesnej nauki [1-3]. Na podstawie projektu sekwencjonowania ludzkiego genomu liczbę par zasad tworzących genom określono na ponad 3 miliardy, a liczbę genów na 22 000-25 000. Za różnice międzyosobnicze wydaje się natomiast odpowiadać zmienność 0,1% materiału genetycznego. Prawdopodobnie większość z nich stanowią polimorfizmy pojedynczego nukleotydu(single nucleotide polymorphism, SNP) [4]. Nazwą tą określane jest często występujące (>1%) zjawisko zmiany pojedynczego nukleotydu w sekwencji DNA. W części przypadków skutkuje to wbudowaniem innego aminokwasu do kodowanego łańcucha polipeptydowego (polimorfizmy zmiany sensu [missense]) lub przedwczesnym zakończeniem transkrypcji (polimorfizmy typu stop kodon [nonsense]). Może to wpływać na strukturę przestrzenną i funkcję syntetyzowanego białka. Inne możliwe polimorfizmy dotyczą m.in. insercji lub delecji określonej liczby nukleotydów lub różnic w ilości sekwencji powtórzonych. Identyfikacja zmian w DNA, które skutkują zmianą sekwencji aminokwasowej kodowanych białek lub dotyczą sekwencji regulatorowych, będzie najpewniej stanowiła podstawę analizy genetycznej, mającej w najbliższym czasie praktyczne zastosowanie w wielu gałęziach medycyny, w tym w zapobieganiu i terapii chorób układu krążenia.
Indywidualizacja prewencji pierwotnej i wtórnej chorób układu krążenia
na podstawie profilu genetycznego
Prewencja to działania mające na celu zapobieżenie nowym (prewencja pierwotna) lub ponownym (prewencja wtórna) zachorowaniom. Niefarmakologiczne działania w zakresie prewencji pierwotnej i wtórnej opierają się przede wszystkim na identyfikacji i zwalczaniu czynników ryzyka przez modyfikację zaleceń dietetycznych, promocję adekwatnego do ogólnego stanu zdrowia wysiłku fizycznego oraz walkę z nałogiem palenia tytoniu.
Do głównych czynników ryzyka choroby niedokrwiennej serca (ChNS) należą wiek, płeć męska, cukrzyca, nadciśnienie tętnicze, palenie tytoniu, zwiększone stężenie cholesterolu całkowitego i trójglicerydów oraz małe stężenie cholesterolu HDL [5]. Oszacowanie ryzyka wystąpienia ChNS w populacji przy obecności powyższych zmiennych nie stanowi problemu, jednak stopień ich wpływu na ryzyko rozwoju ChNS u danego pacjenta zależy w dużym stopniu od osobniczych predyspozycji. Na przykład zmniejszone stężenie cholesterolu HDL – uznany czynnik ryzyka ChNS – nie u wszystkich chorych wiąże się z większym ryzykiem wystąpienia choroby niedokrwiennej serca. Agerholm-Larsen i wsp. wykazali, że polimorfizmy rs1800777 (R451Q) oraz rs5880 (A373P) genu kodującego transferazę estrów cholesterolu (cholesteryl ester transferase protein, CETP) wiążą się z obniżeniem stężenia cholesterolu HDL wśród kobiet i mężczyzn oraz paradoksalnym obniżeniem ryzyka wystąpienia ChNS wśród kobiet [6]. W innej pracy ci sami autorzy na podstawie analizy blisko tysiąca chorych stwierdzili, że wśród kobiet po menopauzie niestosujących hormonalnej terapii zastępczej, u których zidentyfikowano polimorfizm rs5882 (I405V), zwiększone stężenie cholesterolu HDL wiązało się ze wzrostem ryzyka wystąpienia choroby niedokrwiennej serca [7].
Istotnym elementem prewencji pierwotnej i wtórnej chorób układu krążenia jest zmniejszenie wagi ciała u osób z nadwagą i otyłością. Z praktyki klinicznej wiadomo, że jest to zadanie trudne, ponieważ po krótkotrwałym sukcesie często dochodzi do ponownego wzrostu masy ciała [8]. Ponadto wiele leków służących leczeniu otyłości zostało wycofanych z rynku z powodu działań niepożądanych dotyczących układu krążenia (np. sibutramina) lub układu nerwowego (rimnonabant) [9-11]. W 2007 r. opublikowano wyniki badania, w którym na podstawie analizy polimorfizmów 19 genów kodujących m.in. białka związane z metabolizmem kwasu foliowego i lipidów spersonalizowano dietę 50 chorym, zwiększając lub zmniejszając zawartość poszczególnych składników odżywczych i suplementów [12]. Po 300 dniach obserwacji wskaźnik masy ciała (body mass index, BMI) w grupie chorych, którym udzielono porady dietetycznej w oparciu o profil genetyczny, obniżył się średnio o 1,93 kg/m2, natomiast w grupie kontrolnej stosującej dietę śródziemnomorską wzrósł o 0,51 kg/m2 (p <0,023) [12].
Nawyki żywieniowe to także spożywanie herbaty i kawy. Związek między spożywaniem herbaty, zwłaszcza zielonej, a mniejszą zapadalnością na choroby układu krążenia i choroby nowotworowe został potwierdzony w wielu badaniach [13,14]. Uważa się jednak, że biologiczny wpływ zielonej herbaty może zależeć od aktywności enzymów metabolizujących polifenole i być większy u osób z genetycznie uwarunkowaną niską aktywnością tych enzymów [15,16]. Drugą obok herbaty najczęściej stosowaną używką na świecie jest kawa, a kofeina jest najczęściej stosowaną substancją psychoaktywną [17]. Mimo wielu lat badań opinie o bezpieczeństwie spożywania kawy są niejednoznaczne. Niektórzy badacze donosili, że zależność między piciem kawy a zapadalnością na choroby układu krążenia ma kształt zbliżony do krzywej U [18,19], podczas gdy inni nie stwierdzali większego ryzyka wystąpienia ChNS zakończonej i niezakończonej zgonem wśród osób spożywających kawę [20]. Sprzeczne wyniki badań obserwacyjnych można częściowo wytłumaczyć osobniczo zmiennym tempem metabolizmu katecholamin i kofeiny oraz prawdopodobnie różnym odsetkiem tych chorych w analizowanych populacjach. Wykazano, że u osób z polimorfizmem rs4680 (V158M) (warunkującym mniejszą aktywność enzymu metabolizującego katecholaminy [catechol-O-methyltransferase, COMT]) spożywających duże ilości kawy częstość występowania niekorzystnych zdarzeń sercowo-naczyniowych jest większa niż u osób z większą aktywnością tego enzymu [21]. Cornelis i wsp. wykazali ponadto, że polimorfizm rs762551 (-163C>A) warunkujący mniejszą aktywność enzymu metabolizującego m.in. kofeinę CYP1A2 (cytochrome P450, family 1, subfamily A, polypeptide 2) wiąże się z większym ryzykiem zawału mięśnia sercowego wśród osób spożywających kawę [22].
Bardzo ważnym elementem prewencji pierwotnej i wtórnej choroby niedokrwiennej serca jest walka z nałogiem palenia tytoniu. Szacuje się, że w Stanach Zjednoczonych palenie tytoniu jest przyczyną ponad 400 000 zgonów rocznie, a bierne palenie może być przyczyną nawet 30 000-60 000 zgonów rocznie [23,24]. Niekorzystny wpływ palenia wyrobów tytoniowych nie jest jednak taki sam u wszystkich palaczy. W codziennej praktyce często spotykamy osoby, które paląc kilka papierosów dziennie, mają bardziej nasilone zmiany w tętnicach wieńcowych niż osoby palące znacznie większą liczbę papierosów. Do tej pory zidentyfikowano wiele polimorfizmów o potencjalnym związku z inicjacją i wiekiem inicjacji nikotynowej, ryzykiem rozwoju uzależnienia od nikotyny, liczbą wypalanych papierosów i skutecznością terapii antynikotynowej [25,26]. Donoszono także o związku między ryzykiem rozwoju miażdżycy, paleniem tytoniu a polimorfizmem genów warunkującym mniejszą aktywność białek uczestniczących w metabolizmie składników dymu tytoniowego [27]. Być może w przyszłości uda się na podstawie profilu genetycznego zidentyfikować nie tylko osoby zagrożone uzależnieniem od tytoniu, ale także chorych, dla których nawet sporadyczne przebywanie w towarzystwie osób palących może nieść ze sobą katastrofalne skutki.
Budzącym wiele kontrowersji elementem profilaktyki pierwotnej i wtórnej jest suplementacja witamin. W związku z negatywnymi wynikami randomizowanych badań klinicznych nie jest zalecane spożywanie witamin w ilościach większych niż obecnie obowiązujące zapotrzebowanie dobowe [5]. Wyjątek stanowi witamina D, której suplementacja w dawce przynajmniej 1000 j./d wydaje się korzystna i bezpieczna u osób mało eksponowanych na promienie słoneczne [28]. Wiele kontrowersji dotyczyło także suplementacji kwasu foliowego odgrywającego ważną rolę w metabolizmie aminokwasów, w tym homocysteiny. Badania obserwacyjne sugerowały związek między zwiększonym stężeniem homocysteiny a zwiększonym ryzykiem zapadalności na ChNS [29,30]. Randomizowane badania kliniczne wykazały natomiast zależność między suplementacją kwasu foliowego a mniejszym stężeniem homocysteiny, natomiast nie dowiodły korzyści z suplementacji kwasu foliowego w przeciwdziałaniu chorobom układu krążenia [5,31,32]. W związku z tym, że stężenie homocysteiny było także większe w grupie nałogowych palaczy i osób z hipercholesterolemią, istniały wątpliwości, czy hiperhomocysteinemia jest istotnie jedną z przyczyn zawału mięśnia sercowego i udarów mózgu, czy jedynie markerem obecności innych czynników ryzyka. Odpowiedzi na to pytanie może, przynajmniej częściowo, udzielić analiza z zastosowaniem randomizacji mendlowskiej [33]. Założenia randomizacji mendlowskiej opierają się na założeniu, że allele segregują niezależnie podczas podziału mejotycznego prowadzącego do powstania gamet. W związku z tym, analizując wpływ produktu określonego genu na rozwój danej choroby, możemy założyć, że wszystkie inne cechy są rozłożone równomiernie między grupą badaną a kontrolną [33]. Polimorfizm rs1801133 (677C>T) w genie reduktazy metylenotetrahydrofolianu (methylenetetrahydrofolate reductase NAD(P)H, MTHFR) wiąże się z mniejszą aktywnością tego enzymu i w rezultacie z większym stężeniem homocysteiny. Zgodnie z założeniami randomizacji mendlowskiej, allele innych genów dziedziczą się niezależnie i osoby z genotypem warunkującym mniejszą lub większą aktywność enzymu MTHFR powinny być podobne pod względem charakterystyki klinicznej i częstości występowania innych czynników ryzyka choroby niedokrwiennej serca. Można zatem wnioskować, że większa częstość incydentów sercowo-naczyniowych wśród osób z genotypem związanym z mniejszą aktywnością MTHFR jest przyczynowo związana ze zwiększonym stężeniem homocysteiny [33,34], choć nie wszystkie badania wskazują na związek omawianego polimorfizmu z chorobą wieńcową [35]. Biorąc pod uwagę powyższe informacje oraz negatywne wyniki badań klinicznych dotyczące suplementacji kwasu foliowego w prewencji chorób układu krążenia, można postawić tezę, że ewentualne korzyści z suplementacji kwasem foliowym mogą być ograniczone do osób ze zmniejszoną aktywnością MTHFR.
Nowe czynniki ryzyka
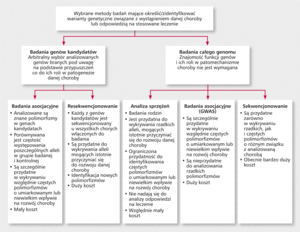
Rycina. Wybrane metody badań służące analizie związków między polimorfizmami a predyspozycją do rozwoju chorób dziedziczonych wielogenowo i odpowiedzią na stosowaną farmakoterapię.
Obecnie ryzyko wystąpienia chorób układu krążenia szacuje się na podstawie analizy klasycznych czynników ryzyka. U blisko 20% osób z ChNS nie stwierdza się jednak żadnego z głównych czynników ryzyka [36]. Do teraz zidentyfikowano wiele rzadkich mutacji determinujących w sposób autosomalny dominujący lub recesywny rozwój niektórych chorób układu krążenia, takich jak zespół wydłużonego QT, zespół Brugadów, rodzinna hipercholesterolemia czy niektóre postacie kardiomiopatii przerostowej [37]. Identyfikacja mutacji związanych z występowaniem rzadkich chorób monogenowych została przeprowadzona w drodze analizy sprzężeń w rodzinach dotkniętych danym schorzeniem. Metoda ta jest jednak niemożliwa do zastosowania w przypadku chorób wielogenowych, w których poszczególne allele zwiększają jedynie nieznacznie ryzyko wystąpienia danej choroby [38]. Analiza sprzężeń nie nadaje się także do analizy odpowiedzi na stosowaną farmakoterapię.
Obecnie udało się jednak zidentyfikować wiele loci (miejsce na chromosomie zajmowane przez allel określonego genu) związanych z predyspozycją do rozwoju chorób układu krążenia za pomocą badań asocjacyjnych całego genomu (genome-wide association studies, GWAS) (rycina). W badaniach GWAS wykazano m.in. związek locus 9p21 z zawałem mięśnia sercowego, tętniakiem tętnic mózgowych, tętniakiem aorty brzusznej, związek locus ABO z chorobą wieńcową i żylną chorobą zatorowo-zakrzepową. Zidentyfikowano także liczne loci o prawdopodobnym związku z niewydolnością serca, udarem niedokrwiennym mózgu czy kardiomiopatią rozstrzeniową [37-42]. Problematyka ta została szeroko omówiona w cytowanym we wstępie artykule autorstwa Christophera J. O’ Donnella i Elizabeth G. Nabel [1].
Indywidualizacja terapii chorób układu krążenia na podstawie profilu genetycznego
Obecnie terapia chorób układu krążenia opiera się na wytycznych towarzystw medycznych opracowanych na podstawie wyników randomizowanych badań klinicznych oraz, w niektórych przypadkach, o opinie ekspertów i wyniki badań obserwacyjnych. Decyzje kliniczne podejmowane są coraz częściej w oparciu o algorytmy postępowania. Zalecenia te doskonale sprawdzają się w standardowych przypadkach, jednak w wielu sytuacjach odniesienie się do wytycznych jest niewystarczające lub wręcz niemożliwe. Randomizowane badania kliniczne, na których oparte są zalecenia towarzystw kardiologicznych, obwarowane są licznymi kryteriami włączenia i wykluczenia z badania. W przypadku ostrych zespołów wieńcowych do 50% chorych spotykanych w praktyce klinicznej może nie być reprezentowanych w badaniach klinicznych [43,44]. Lukę tę częściowo uzupełniają rejestry. Ze względu jednak na ograniczenia metodyczne badań obserwacyjnych nie są one w stanie dostarczyć dowodów tak jednoznacznych, jak badania randomizowane [43]. Wyniki badań klinicznych stanowią ponadto uśrednienie odpowiedzi na farmakoterapię czy działania inwazyjne. Wiele badań klinicznych zostało przerwanych z powodu wystąpienia u nielicznych pacjentów poważnych działań niepożądanych, podczas gdy badany lek mógł potencjalnie przynieść korzyści znacznie większej grupie osób. Podobnie wpływ wielu badanych leków nie różnił się od efektu placebo, podczas gdy potencjalnie mogła istnieć grupa chorych, u której badany lek mógł być skuteczny. Odpowiedzi na pytania o profil ryzyka i korzyści farmakoterapii dla konkretnego chorego może udzielić farmakogenomika, której przyświeca idea dopasowania odpowiedniego leku dla odpowiedniego pacjenta (the right drug for the right patient). Obecnie zidentyfikowano wiele polimorfizmów o potencjalnym związku z działaniem lub metabolizmem stosowanych leków w leczeniu chorób układu krążenia. Wybrane przykłady zawiera tabela [45-61].