Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Praktyka kliniczna
Leczenie systemowe raka pęcherza moczowego
Lek. Bartosz Itrych1
Dr hab. med. Wojciech Majewski2
Dr n. med. Wojciech Rogowski1
Rak pęcherza moczowego stanowi ok. 5 proc. wszystkich nowotworów złośliwych w krajach Unii Europejskiej. Zajmuje 4. miejsce pod względem częstości występowania u mężczyzn oraz 11. u kobiet. Ryzyko rozwoju raka pęcherza moczowego poniżej 75. r.ż. wynosi ok. 3 proc. u mężczyzn i ok. 0,5 proc. u kobiet. Obserwuje się zmniejszenie umieralności z powodu tego nowotworu o 16 proc. u mężczyzn i o 12 proc. u kobiet w ciągu dekady.[1]
U 75-85 proc. chorych w chwili rozpoznania ma charakter powierzchowny i ograniczony do błony śluzowej (Ta-Tis) lub podśluzowej (T1). Wśród pozostałych 15-25 proc. stwierdza się stopień T2 – naciekanie błony mięśniowej lub przerzuty do węzłów chłonnych (T2-T4, N+). Radykalna cystektomia zalecana jest u chorych z rozpoznaniem raka pęcherza moczowego w stopniu zaawansowania T2-T4a, N0M0 i w przypadku raka pęcherza moczowego bez naciekania warstwy mięśniowej, lecz z obecnością czynników wysokiego ryzyka nawrotu. Leczenie systemowe z wykorzystaniem cisplatyny jest standardem postępowania w nieresekcyjnym lub przerzutowym raku pęcherza moczowego.
W Polsce w 2010 roku zarejestrowano 4919 zachorowań u mężczyzn i 1377 zachorowań u kobiet (standaryzowany współczynnik zachorowalności, odpowiednio 17,0 oraz 3,5/100 000/rok).[1] Standaryzowany współczynnik umieralności wyniósł odpowiednio 8,1 oraz 1,28/100 000/rok. Odnotowano 2470 zgonów wśród mężczyzn i 641 wśród kobiet. Wiek, w którym najczęściej rozpoznaje się raka pęcherza moczowego u obu płci, zawiera się w przedziale 70-74 lat.

Tabela 1. Histologiczne postacie inwazyjnego raka pęcherza moczowego i górnych dróg moczowych według WHO.[2]
Rozpoznanie patologiczne powinno być wykonywane zgodnie z zaleceniami Światowej Organizacji Zdrowia (World Health Organization – WHO) na podstawie materiału pobranego podczas przezcewkowej resekcji guza (transurethral resection of the bladder tumour – TURBT). Rak urotelialny jest najczęstszą postacią histologiczną raków pęcherza moczowego i występuje w mniej więcej 90 proc. przypadków. Histologiczne postacie inwazyjnego raka pęcherza moczowego przedstawiono w tabeli 1.
Staging i ocena czynników ryzyka
Wywiad chorobowy należy dokładnie przeprowadzić, jak również wykonać badanie przedmiotowe, włącznie z badaniami laboratoryjnymi obejmującymi morfologię krwi oraz parametry nerkowe. Już USG pęcherza moczowego często pokazuje nieprawidłowe zmiany w jego obrębie. Lecz ostateczne potwierdzenie obecności patologicznej zmiany o charakterze nowotworowym uzyskujemy podczas badania cystoskopowego z pobraniem wycinków do badania histopatologicznego. Badanie cystoskopowe oraz badanie TURBT podczas znieczulenia powinno być standardowym postępowaniem. Jeśli istnieje możliwość techniczna, zaleca się całkowitą resekcję podejrzanych zmian. Podczas TURBT powinno się dokumentować liczbę guzów, ich wymiary oraz obecność inwazji pozapęcherzowej lub okołopęcherzowej.
Biopsje z cewki moczowej i sterczowej powinny być pobierane w sytuacji obecności zmiany w okolicy trójkąta pęcherza moczowego, jego szyi lub jeśli nie stwierdzamy obecności zmiany pierwotnej. Leczenie raka pęcherza moczowego opiera się na ocenie wyniku badania hist-pat (ze zwróceniem szczególnej uwagi na histologię), stopnia złośliwości, głębokości inwazji. W przypadku potwierdzenia inwazji warstwy mięśniowej miejscowe zaawansowanie powinno być ocenione przy wykorzystaniu badań obrazowych: tomografii komputerowej i rezonansu magnetycznego. Aktualnie zaleca się również wykonywanie badań CT i MRI w celu oceny stopnia zaawansowania choroby.
Chłonka z pęcherza moczowego spływa do węzłów chłonnych należących do pierwszej i drugiej stacji regionalnych węzłów chłonnych (tabela 2).
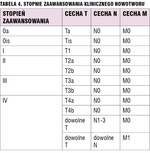
Przerzuty w węzłach chłonnych zaotrzewnowych traktuje się jak przerzuty odległe (z wyjątkiem tych węzłów przestrzeni zaotrzewnowej, które wymieniono wyżej jako regionalne). Klasyfikację TNM raka pęcherza moczowego przedstawiono w tabeli 3. Obowiązujący podział stopni zaawansowania raka pęcherza moczowego znajduje się w tabeli 4.
Leczenie miejscowo zaawansowanego raka pęcherza moczowego – z naciekiem warstwy mięśniowej
Radykalna cystektomia z rozszerzoną limfadenektomią (co najmniej 15 węzłów chłonnych) jest standardem leczenia w MIBC (muscle invasive bladder cancer). Polega na wycięciu pęcherza moczowego, stercza i pęcherzyków nasiennych u mężczyzn oraz macicy z przydatkami, przedniej ściany pochwy oraz często całej cewki moczowej u kobiet. Radykalna cystektomia zalecana jest u chorych z rozpoznaniem raka pęcherza moczowego w stopniu zaawansowania T2-T4a, N0M0 i w przypadku raka pęcherza moczowego bez naciekania warstwy mięśniowej, lecz z obecnością czynników wysokiego ryzyka nawrotu. Integralną częścią radykalnej cystektomii jest lifadenektomia rozszerzona (lymph node dissection – LND). Rozszerzona limfadenektomia wiąże się z korzyścią kliniczną i może być skuteczna u pacjentów z przerzutami do kilku węzłów chłonnych lub z mikroprzerzutami. PFS i OS korelują z ilością zajętych węzłów chłonnych usuniętych podczas operacji. Wśród pacjentów niekwalifikujących się do cystektomii radioterapia stanowi alternatywną metodę leczenia w leczeniu radykalnym. Podaje się wówczas w pierwszym etapie 40-45 Gy z podwyższeniem dawki do 64-66 Gy na obszar guza z marginesem.
Leczenie neoadiuwantowe i adiuwantowe
Skuteczność cisplatyny w leczeniu neoadiuwantowym została potwierdzona w 11 randomizowanych badaniach klinicznych obejmujących 3005 pacjentów. Obserwowano wzrost o 5 proc. pięcioletnich OS i o 9 proc. pięcioletnich PFS w porównaniu z radykalną cystektomią jako wyłączne leczenie.[4,5] W metaanalizie dziewięciu badań randomizowanych obejmujących 945 pacjenów, leczonych adiuwantowo chemioterapią z udziałem cisplatyny, wykazano korzyść w zakresie przeżyć całkowitych – OS (HR 0,77, CI 95% 0,45-0,91, P = 0,049) i przeżyć bez progresji choroby – DFS (HR 0,66, 95% CI 0,45-0,91, P = 0,014). Większą korzyść w zakresie DFS odnieśli chorzy z przerzutami do węzłów chłonnych.[6] Chemioterapia neoadiuwantowa jest rekomendowana dla raka pęcherza moczowego w stopniu zaawansowania T2-T4a, cN0M0 i powinna być oparta o cisplatynę. Chemioterapia neoadiuwantowa nie jest zalecana u pacjentów, którzy nie kwalifikują się do leczenia systemowego z wykorzystaniem cisplatyny. Obecnie nadal brak jednoznacznych wskazań do zastosowania chemioterapii uzupełniającej w rutynowej praktyce. Jednakże wśród pacjentów z obecnością czynników wysokiego ryzyka nawrotu, tj. naciekanie okołopęcherzowych struktur lub przerzuty do węzłów chłonnych, zastosowanie uzupełniającej chemioterapii wiąże się z uzyskaniem korzyści klinicznych. Alternatywnym leczeniem dla radykalnej cystektomii jest zastosowanie leczenia oszczędzającego narząd. Zaleca się, aby leczenie oszczędzające wdrażane było u pacjentów niekwalifikujących się do cystektomii w związku z obecnością chorób towarzyszących. Powyższe postępowanie terapeutyczne przebiega w kilku etapach:[1]