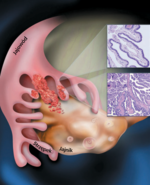
Profilaktyczne usunięcie przydatków
Przyszłość zapobiegania rakowi jajnika?
A. Rauda Tellawi, MD, Vadim V. Morozov, MD
Rak jajnika cieszy się złą sławą rozpoznawania w późnym stadium zaawansowania i złego rokowania. Zaproponowano wiele teorii na temat pochodzenia i rozwoju tego nowotworu zarówno u kobiet z mutacją, jak i bez mutacji genu BRCA. Autorzy wcześniejszych teorii podkreślali, że rak wywodzi się z jajnika, a wielokrotne cykle owulacyjne, jak również prawdopodobnie procesy zapalne toczące się w miednicy, zapoczątkowują mutacje prowadzące ostatecznie do utraty kontroli przez geny supresorowe nowotworu.
Wyniki późniejszych badań ujawniły jednak, że rak jajnika może się również wywodzić z jajowodu, a zwłaszcza z lejka jajowodu. Praktykujący ginekolog musi zatem rozstrzygnąć, czy powinien proponować chorym profilaktyczne usunięcie przydatków, by zapobiec rozwojowi pierwotnego raka jajnika. Czy w trakcie planowej operacji, takiej jak podwiązanie jajowodów lub usunięcie macicy, powinien obustronnie wyciąć całe przydatki?
Brakuje wprawdzie prospektywnych randomizowanych badań klinicznych poświęconych temu zagadnieniu, autorzy artykułu postanowili jednak przeanalizować dostępne informacje.
Skala problemu
W samych Stanach Zjednoczonych każdego roku rozpoznaje się raka jajnika u niemal 22 000 kobiet, na świecie zaś u 190 000. Co roku nowotwór ten jest przyczyną 16 000 zgonów w Stanach Zjednoczonych i 114 000 zgonów na świecie.1 Istnieją wprawdzie czynniki ryzyka rozwoju raka jajnika, które można modyfikować, np. stosowanie doustnych środków antykoncepcyjnych, ale jednym z czynników, na które nie można wpłynąć, jest rodzinne występowanie raka jajnika. Co najmniej 10% raków jajnika rozwija się u kobiet z mutacją genu BRCA, wśród których zagrożenie zachorowaniem na ten nowotwór w ciągu życia sięga 27-56%. W grupie kobiet z mutacją genu BRCA, które zdecydowały się poddać operacji profilaktycznej, przeżycie wolne od nowotworu wynosi około 96%, podczas gdy wśród decydujących się jedynie na wnikliwą obserwację – 69%.2
Ten wysoki wskaźnik skuteczności operacji profilaktycznej w populacji kobiet z mutacją genu BRCA osiąga się dzięki usunięciu tkanki, w której może dojść do transformacji złośliwej, zanim to nastąpi. Przede wszystkim trzeba jednak odpowiedzieć na pytanie, skąd wywodzi się rak jajnika, by w trakcie operacji profilaktycznej usunąć możliwie jak najmniej tkanek, a jednocześnie osiągnąć jak największą korzyść dla pacjentki.
Teorie rozwoju raka jajnika
Rozpowszechnione są dwie teorie wyjaśniające powstawanie i progresję raka jajnika. Uważa się, że do rozwoju raka endometrialnego jajnika i raków jasnokomórkowych dochodzi w następstwie wielu zdarzeń genetycznych, takich jak mutacje w genach naprawy DNA (naprawa niesparowanych zasad, mismatch repair, MMR) aktywujące szlak przemian KRAS/BRAF, aktywacja β-kateneiny oraz mutacje PTEN. Wydaje się, że w wyniku mutacji szlaku KRAS/BRAF progresja w kierunku raka jajnika postępuje wolniej.
Zdaniem niektórych badaczy zmianom w cyklu komórkowym sprzyja powstawanie endometrialnych torbieli jajnika tworzących się w następstwie wstecznego odpływu krwi miesiączkowej.3 Inni uważają, że rak jajnika wywodzi się z endometriozy w wyniku uszkodzenia spowodowanego ekspozycją na czynnik Müllera w trakcie miesiączki lub nawet w wyniku powstawania torbieli jajnika, których wgłobianie wywołuje narastające uszkodzenie DNA. Jeszcze inni sądzą, że toczące się w miednicy procesy zapalne mogą być przyczyną stresu oksydacyjnego i zmian zachodzących w szlakach przemian.4
Obraz patomorfologiczny innych nowotworów nabłonkowych jajnika może przemawiać za występowaniem transformacji złośliwej w następstwie mutacji genu supresorowego nowotworu TP53. Mutacja ta przyczynia się do rozwoju raka surowiczego jajnika, którzy wcześnie tworzy przerzuty w wyniku bezpośredniego rozsiewu w jamie otrzewnej.
Powstało wiele teorii wyjaśniających zapoczątkowywanie zmian w genach supresorowych nowotworu. W 1971 r. Fathalla opracował teorię tzw. nieustannej owulacji, zgodnie z którą powtarzające się podczas każdego cyklu owulacyjnego uszkodzenia przez stres oksydacyjny, a następnie naprawa nabłonka jajnika zwiększają ryzyko rozwoju nowotworu.5
W 1983 r. Cramer i Welch przedstawili hipotezę zakładającą, że regularna stymulacja gonadotropowa i zwiększone stężenia estrogenów pobudzają rozplem nabłonka jajnika, co zwiększa ryzyko uszkodzenia DNA i rozwoju nowotworu.6
Postępy w rozumieniu mechanizmów rozwoju raka jajnika
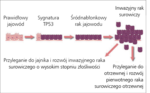
Rycina 1. Morfologiczny rozwój raka surowiczego o wysokim stopniu złośliwości wywodzącego się z jajowodu.
W ostatnich latach badacze z Massachusetts General Hospital w Bostonie oraz z innych ośrodków stwierdzili silną ekspresję TP53 w strzępkach jajowodu zarówno u kobiet z mutacją genu BRCA, jak i u kobiet bez mutacji.1 W doniesieniu opublikowanym w 2007 r. Crum i wsp. przedstawili protokół przygotowywania skrawków tkankowych i dokładnego badania strzępków jajowodu w celu odnalezienia sygnatur TP53, czyli miejsc występowania licznych kopii genów supresorowych nowotworu TP53.2 Poszukiwali też cech wczesnych śródnabłonkowych raków jajowodu (tubal intraepithelial carcinoma, TIC) oraz sygnatur TP53 u kobiet z mutacją genu BRCA poddanych operacji profilaktycznej, a także u kobiet operowanych z powodu innych chorób łagodnych lub złośliwych (np. mięśniaków lub raka trzonu macicy).
Sygnatury TP53 w strzępkach jajowodów stwierdzili u 80% kobiet z mutacją genu BRCA i 89% kobiet bez mutacji. Sygnatura TP53 występowała we wszystkich TIC.
Proces zapalny towarzyszący powtarzającej się owulacji, a także odpływ wsteczny krwi miesiączkowej mogą być czynnikami wyzwalającymi kaskadę ekspresji i mutacji TP53 oraz metaplazję (ryc. 1).4,7 Chociaż rak jajnika może się wywodzić z miejsc występowania sygnatur TP53 w strzępkach jajowodu, nie uznaje się go za pierwotny nowotwór jajowodu, ponieważ składowa jajowodowa nie jest dominującą ani nie jest on rozpoznawany jako pierwszy u większości chorych na raka jajnika (ryc. 2).7,8
Ta nowa teoria powstawania raka jajnika nasuwa ginekologom kolejne pytania. Czy w przyszłości kobietom z mutacją genu BRCA wystarczy zaproponować proste wycięcie jajowodu? Czy wykonanie w trakcie histerektomii profilaktycznego wycięcia lub podwiązania jajowodu jest skuteczną metodą pozwalającą zapobiec ryzyku rozwoju raka jajnika u kobiet bez mutacji genu BRCA? Czy wszystkim takim kobietom powinno się proponować obustronne usunięcie przydatków (bilateral salpingo-oophorectomy, BSO)?