Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Programowanie w życiu płodowym a otyłość w wieku dorosłym
Michael G. Ross, MD, MPH, Mina Desai, MSC, PHD
Wyniki badań wskazują, że warunki wewnątrzmaciczne prowadzące do małej masy urodzeniowej przyczyniają się do zwiększenia ryzyka otyłości w wieku dorosłym. Pomoc pacjentce w uniknięciu zaburzeń odżywiania może zatem służyć optymalizacji stanu zdrowia jej dzieci w przyszłości.
Dwudziestoośmioletnia Mary Jane, C2P1, zgłasza się na wizytę kontrolną w 8 tygodniu ciąży. Ma 168 cm wzrostu, waży 47,5 kg. Pracuje na eksponowanym stanowisku w branży technologicznej i w czasie ciąży bardzo chciałaby utrzymać swój wygląd. W pierwszej ciąży przytyła tylko 4,5 kg i w 38 tygodniu urodziła zdrowe dziecko ważące 2200 g. Co należy radzić pacjentkom w kwestii odżywiania i przyrostu masy ciała w czasie ciąży?
Do zapamiętania
• Mała masa urodzeniowa jest związana z istotnym zwiększeniem częstości chorób serca w wieku dorosłym, nieprawidłowej tolerancji glukozy i cukrzycy.
• Badania u ludzi pozwalają przypuszczać, że otyłość matki w czasie ciąży prowadzi do zwiększenia ryzyka otyłości jej potomstwa w dzieciństwie i w wieku dorosłym.
• Związek wzrastania płodu z otyłością w późniejszym wieku stanowi kontinuum, istnieje zatem pewnie optymalna masa urodzeniowa, przy której potencjał programowania otyłości jest minimalny.
Opieka prenatalna
Sformalizowany system opieki prenatalnej powstał w Stanach Zjednoczonych na początku XX wieku i obejmował 3 wizyty. Wskaźniki śmiertelności matek na początku XX wieku osiągały prawie 1%, a główne przyczyny obejmowały stan przedrzucawkowy, zakażenia i krwotoki. Opieka prenatalna skupiała się na tych trzech powikłaniach: podczas każdej wizyty wykonywano badania ciśnienia tętniczego pacjentki i zawartości białka w moczu w celu rozpoznania stanu przedrzucawkowego, badanie ogólne moczu w celu rozpoznania zakażenia oraz określano wartość hematokrytu, aby zapobiegać niedokrwistości i powikłaniom krwotoku. Te działania, podobnie jak inne mające na celu poprawę opieki medycznej (bankowanie krwi, zwrócenie uwagi na aseptykę, antybiotyki), spowodowały istotne zmniejszenie śmiertelności matek do 1 na 10 000 ciąż w Stanach Zjednoczonych. Wraz z tak istotnym zmniejszeniem śmiertelności matek zmieniły się cele opieki prenatalnej, zwrócono uwagę na zmniejszenie chorobowości i umieralności płodów i noworodków oraz wcześniactwa,1 a ostatnio na rozpoznawanie (diagnostyka ultrasonograficzna, markery, amniopunkcja), zapobieganie (suplementacja kwasu foliowego) i leczenie (operacje wewnątrzmaciczne i u noworodków) wad wrodzonych.
Programowanie w trakcie rozwoju
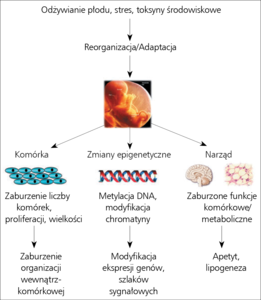
Opieka prenatalna zaczyna się teraz skupiać na odległych następstwach poprawy stanu zdrowia płodu w celu zapobiegania chorobom w wieku dziecięcym i dorosłym. Programowanie w trakcie rozwoju można zdefiniować jako trwałą zmianę w strukturze lub funkcji tkanek, powstającą w następstwie oddziaływania środowiska wewnątrzmacicznego. Koncepcja programowania w życiu płodowym zyskuje coraz większe uznanie poparte przekonującymi wynikami badań epidemiologicznych przeprowadzonych u ludzi oraz na modelach zwierzęcych.2,3 Szczególnie wewnątrzmaciczne narażenie na zaburzenia odżywiania u matki (nadmiar lub niedobór), stres (np. glikokortykosteroidy) lub toksyny środowiskowe może zmieniać strukturę narządów i ich funkcjonowanie. Skoro około 50% wszystkich podziałów komórkowych następuje od poczęcia do porodu, nie jest zaskakujące, że niekorzystne warunki środowiskowe mogą wpływać na liczbę komórek. Chociaż zaprogramowany genotyp potomka się nie zmienia, modyfikacja ekspresji genów może być następstwem zmian epigenetycznych wywołanych ekspozycją na różne czynniki, zmieniając tym samym ekspresję białek regulatorowych i funkcję narządów (ryc. 1).
W rzeczywistości dwa często w przeszłości przytaczane teratogeny działają przez epigenetyczne programowanie. Talidomid, który był przepisywany w latach 50. XX wieku jako lek nasenny i łagodzący poranne nudności, będący składnikiem ponad 50 preparatów dostępnych bez recepty, powodował zahamowanie rozwoju kończyn za pośrednictwem epigenetycznego procesu hamującego angiogenezę.4 Równie poważne było działanie dietylostilbestrolu (DES), który był stosowany poza zarejestrowanymi wskazaniami u kobiet z poronieniami w wywiadzie zgodnie z rejestracją przez US Food and Drug Administration (FDA) z 1947 roku. W 1971 roku FDA zareagowało na dowody wskazujące, że u płodów płci żeńskiej narażonych na DES występuje zwiększone ryzyko raka jasnokomórkowego pochwy, w odpowiedzi na wewnątrzmaciczną hipermetylację genów.5
Mała masa urodzeniowa
Jak wiadomo, mutacje genetyczne, które typowo pojawiają się w bardzo długich przedziałach czasowych, są korzystne dla przetrwania gatunków i są na ogół nieodwracalne. Programowanie w wieku rozwojowym z kolei powstało w toku ewolucji, aby umożliwić płodowi przygotowanie się do warunków środowiska pozamacicznego, zwłaszcza do braku wody lub głodu. W warunkach głodu ograniczenie dostępu do matczynych składników odżywczych prowadzi do małej masy urodzeniowej u niemowląt, które w przeszłości przez całe życie funkcjonowałyby w środowisku o ograniczonej dostępności pożywienia. Nawiasem mówiąc, noworodki z małą masą urodzeniową często są określane jako „oszczędny fenotyp”, przejawiający się zwiększonym apetytem i spożywaniem dużych ilości pokarmu, wydajnym metabolizmem oraz ograniczeniem wydatków energetycznych – zaprogramowany „leń” (ryc. 2).6 Hales i Barker zauważyli, że niemowlęta z małą masą urodzeniową i oszczędnym fenotypem odnosiłyby korzyści w środowisku o zmniejszonej dostępności pożywienia.
W Stanach Zjednoczonych mamy jednak do czynienia z noworodkami z „niezamierzenie oszczędnym fenotypem”. Kobiety z poważnymi schorzeniami często rodzą dzieci z małą masą urodzeniową, podczas gdy mniej niż wiek temu nie dożyłyby do wieku prokreacyjnego. Używanie substancji psychoaktywnych (np. kokaina, metamfetamina, tytoń) istotnie przyczynia się do ograniczenia wzrastania, a zapłodnienie pozaustrojowe wywołało gwałtowne zwiększenie liczby dzieci z małą masą urodzeniową w następstwie ciąż wielopłodowych. Podczas gdy w przeszłości wiele, jeśli nie większość, noworodków ze skrajnie małą masą urodzeniową by nie przeżyło, obecnie, dzięki poprawie opieki prenatalnej granica przeżywalności noworodków jest oceniania na 440 g. Przeżywające noworodki z małą masą urodzeniową, zaprogramowane na oszczędny fenotyp, otrzymują następnie bogatotłuszczową, wysokokaloryczną dietę, żyjąc w niewymagającym dużego wydatku energetycznego środowisku współczesnego Zachodu.
Zaprogramowana otyłość
Po części następstwem programowania w życiu płodowym jest otyłość, dominujący problem zdrowia publicznego. W Stanach Zjednoczonych osoby z nadwagą stanowią wśród dorosłych 66%, a 36% jest otyłych.7 Rasa/pochodzenie etniczne są w nieodłączny sposób związane z otyłością u dzieci i nastolatków, która częściej występuje wśród Afroamerykanów, Amerykanów pochodzenia meksykańskiego i rdzennych Amerykanów w porównaniu z innymi grupami etnicznymi.8,9 Wyniki badań epidemiologicznych potwierdzają wpływ niedostatecznego odżywienia matki na programowanie zespołu metabolicznego. Barker i wsp. wykazali istotne zwiększenie częstości występowania zespołu metabolicznego wraz ze zmniejszeniem masy urodzeniowej.2 Jako czynnik przyczyniający się do wzrostu chorobowości mała masa urodzeniowa jest związana z istotnie częstszym występowaniem chorób serca w wieku dorosłym, nieprawidłową tolerancją glukozy i cukrzycą. Dodatkowo, najwięcej noworodków z małą masą urodzeniową rodzą czarne kobiety (11,8%) w porównaniu z białymi (7,1%) i Latynoskami (5,3%) oraz kobietami z Azji i wysp Pacyfiku (8,4%).10
Jak omówiono powyżej, płód z fenotypem oszczędnym został przygotowany do środowiska pozamacicznego, w którym brakuje pożywienia. Gluckman i Hanson rozwinęli tezę „dopasowanie-niedopasowanie”, według której zaprogramowana otyłość ujawnia się wtedy, kiedy płód z oszczędnym fenotypem otrzymuje po urodzeniu wystarczającą lub nadmierną ilość składników odżywczych, a następnie jest żywiony bogatotłuszczową zachodnią dietą.11 W istocie szybkie „nadrabianie” wzrastania u dziecka z małą masą urodzeniową może stanowić czynnik predykcyjny otyłości w dzieciństwie i wieku dorosłym (ryc. 2).6