Zamówienia złożone w dniach 29.04 - 06.05 zostaną wysłane po 06.05. Aby zrekompensować te niedogodności, zamówienia złożone w tym terminie są objęte Majówkową Darmową Dostawą >
Klasyczne mechanizmy rozwoju niewydolności serca
W PChN aktywowanych jest wiele mechanizmów znanych z patofizjologii niewydolności serca. Nawet przy umiarkowanym zawansowaniu PChN z filtracją kłębuszkową w zakresie 30-70 ml/min/1,73 m2 liczba impulsów w neuronach sympatycznych zmierzona za pomocą mikroneurografii jest zwiększona [21]. Towarzyszy temu znacznie zwiększone stężenie noradrenaliny we krwi. Zahamowanie aktywności sympatycznej można osiągnąć, blokując układ renina-angiotensyna-aldosteron (RAA) za pomocą enalaprilu lub stosując leki blokujące układ sympatyczny [21]. Układ reninowy ulega aktywacji wcześnie w przebiegu PChN. Już u chorych w II lub III klasie zaawansowania choroby aktywność reninowa jest istotnie zwiększona [22] i nie zależy od czynności serca. Równolegle do aktywacji układu reninowego i sympatycznego w przewlekłej chorobie nerek aktywacji ulegają także inne układy hormonalne. Do najważniejszych zaliczyć należy wazopresynę i endotelinę.
Konsekwencją wzmożonej aktywności sympatycznej i układu reninowego jest powstawanie wolnych rodników tlenowych, co prowadzi m.in. do zmniejszenia biodostępności tlenku azotu, który jest bardzo ważnym regulatorem napięcia naczyń oporowych oraz regulatorem wewnątrznerkowej regulacji przepływu krwi i natriurezy [23].
Zapalenie to jedno z kluczowych zjawisk w przewlekłej chorobie nerek, a jego przyczyny nie są do końca poznane. Istotne jest jednak to, że proces zapalny prowadzi także do aktywacji zarówno układu RAA, neuronów sympatycznych, jak i aktywacji leukocytów i produkcji wolnych rodników tlenowych [24]. Te ostatnie zjawiska przyspieszają miażdżycę.
Wymienione ogniwa patogenetyczne aktywowane są we wczesnych etapach zaawansowania PChN. Pozostają w ścisłych wzajemnych relacjach i wpływają na siebie aktywująco. Wynikiem ich działania jest patologiczna przebudowa serca i naczyń, ponieważ hormony i mediatory aktywowane w tym procesie indukują przerost miocytów, rozplem fibroblastów, zwiększają ekspresję cząstek podtrzymujących zapalenie i włóknienie serca i tętnic.
Mechanizmy rozwoju niewydolności serca swoiste dla PChN
Progresja choroby nerek uruchamia wiele zjawisk swoistych dla tego zespołu chorobowego. Są one konsekwencją zmniejszania filtracji kłębuszkowej i narastających zaburzeń homeostatycznych. Do najlepiej poznanych należy niedokrwistość. Występuje ona niezależnie od niewydolności serca i skojarzona jest ze zwiększoną śmiertelnością [25]. Niedokrwistość jest konsekwencją niedoboru erytropoetyny i oporności szpiku na jej działanie i pogłębia się wraz ze spadkiem filtracji. Istotne zmniejszanie stężenia hemoglobiny zauważalne jest już od filtracji <70 ml/min/1,73 m2 u mężczyzn i <50 ml/min/1,73 m2 u kobiet [26]. Prawdopodobieństwo rozwoju niedokrwistości o osoby z cukrzycą jest około trzykrotnie większe niż pacjenta bez cukrzycy.
Niedokrwistość prowadzi do niedotlenienia tkanek, rozszerzenia naczyń, obniżenia lepkości krwi i aktywacji sympatycznej, co skutkuje tachykardią i zwiększoną pojemnością minutową. Wiedzie to do przerostu, zmiany geometrii i poszerzenia lewej komory [27], a w końcu do rozstrzeni i rozwoju niewydolności serca [28]. Niedokrwistość powoduje także przebudowę dużych tętnic oraz zwiększa wrażliwość serca na niedokrwienie. U dializowanych zmniejszeniu stężenia hemoglobiny o 1 g/dl towarzyszy wzrost ryzyka rozwoju niewydolności serca o 28% [28].
Z obniżaniem się filtracji <90-100 ml/min/1,73 m2 utrzymanie stałego stężenia fosforanów wymaga aktywacji hormonów nasilających wydalanie fosforanów z moczem oraz zmniejszenia wchłaniania w przewodzie pokarmowym. Efekt ten osiągany jest dzięki wzrostowi syntezy parathormonu, fibroblastowego czynnika wzrostu 23 (FGF-23) oraz supresji syntezy kalcytriolu – 1,25[OH]2D3 [29]. Nadczynność przytarczyc, wzrost stężenia FGF-23 i zahamowanie układu hormonalnego witaminy D3 są wiązane niezależnie od siebie z ryzykiem przerostu lewej komory, włóknieniem serca i przebudową naczyń [30-32]. Pojawiająca się w dalszych okresach PChN niezależnie od tych adaptacji hiperfosfatemia nasila zwapnienia pozakostne i prowadzi do stwardnienia dużych naczyń [33]. Każdy z tych czynników skojarzony jest także ze zwiększonym ryzykiem rozwoju lub zaostrzenia niewydolności serca [34-36].
Równolegle do spadku filtracji kłębuszkowej objętość płynu zewnątrzkomórkowego się zwiększa. Czynnik ten wiąże się ze wzrostem ciśnienia tętniczego i postępującym przerostem lewej komory. Ostatnio wykazano, że skuteczna kontrola objętości płynu zewnątrzkomórkowego za pomocą furosemidu u chorych z filtracją 60-15 m/min/1,73 m² i bardzo dobrą kontrolą ciśnienia tętniczego z wykorzystaniem inhibitora konwertazy angiotensyny prowadzi do regresji przerostu lewej komory [37]. Wynik randomizowanego kontrolowanego za pomocą placebo badania sugeruje dominującą rolę hiperwolemii w genezie przerostu lewej komory w tej grupie chorych. Podwyższone ciśnienie w prawym przedsionku, utrudniając odpływ chłonki z obszaru serca i płuc, potęguje obrzęk miokardium, indukuje postępujące włóknienie serca, nasila niedokrwienie wywołane zwężeniem tętnicy wieńcowej, zwiększając tym samym ryzyko rozwoju niewydolności serca [38,39]. Od czasu pierwszego opisu w końcu lat 60. ubiegłego wieku [40] rola nieprawidłowej czynności układu chłonnego u ludzi z niewydolnością serca została prawie zupełnie zapomniana. Obecnie warto przypomnieć o tym zjawisku, ponieważ jego znaczenie dla rozwoju patologicznej przebudowy serca u osób z przewlekłą hiperwolemią może być większe, niż dotychczas sądzono.
Przewlekła hiperwolemia ma także znaczenie dla funkcji naczyń. Badania u dializowanych wskazują, że u osób ze zwiększoną objętością płynu wewnątrznaczyniowego szybkość fali tętna jest zwiększona [41]. To oznacza zwiększoną sztywność tętnic, co nasila ryzyko rozwoju niewydolności serca.
Neuropatia autonomiczna jest częstym zjawiskiem u chorych z PChN. Związana jest ona ze zwiększonym ryzykiem przerostu lewej komory [42], hipoksemią nocną i zespołami bezdechów sennych, skłonnością do powstawania zaburzeń rytmu serca oraz hipotonii dializacyjnej [43]. Wszystkie te zjawiska są czynnikami ryzyka rozwoju lub pogłębiają już obecne objawy niewydolności serca. Odnerwienie parasympatyczne, szczególnie częste w PChN, powoduje stałe przyspieszenie rytmu serca oraz stanowi czynnik ryzyka nagłego zgonu.
Większość chorych w okresie leczenia dializami ma wykonaną przetokę tętniczo-żylną. Jej obecność niesie dwojakie zagrożenia. W przypadku dużego przepływu istnieje ryzyko rozwoju niewydolności serca ze zwiększoną pojemnością minutową, a w przypadku jej zakażenia – ryzyko infekcyjnego zapalenia wsierdzia z jego konsekwencjami, do których zwykle należy ponownie niewydolność serca.
Patologiczna przebudowa serca i naczyń w PChN
W wyniku wszystkich wspomnianych procesów w układzie krążenia następuje patologiczna przebudowa. Początkowo jest ona adaptacją do zmieniających się warunków hemodynamicznych i zmian środowiska. W dalszym etapie zmiany morfologiczne stają się patofizjologicznie niekorzystne.
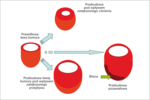
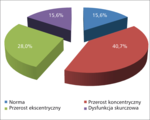
Patologiczna przebudowa obserwowana jest zarówno w sercu, jak i w tętnicach. Jej charakter zależy od dominującego profilu czynników ryzyka i etapu choroby nerek. Podstawowe rodzaje przebudowy tętnic przedstawiono na rycinie 2. Wzrost szybkości przepływu powoduje przede wszystkim zwiększenie światła naczynia z zauważalnym pogrubieniem ścian tętnic. Przewlekły wzrost ciśnienia tętniczego indukuje zwiększenie grubości ścian z towarzyszącym zmniejszeniem światła naczynia. Uszkodzenie endotelium przez różne czynniki (nadciśnienie, tytoń, lipidy, zapalenie) może zapoczątkować przebudowę o typie miażdżycowym. Wszystkie trzy typy przebudowy tętnic rozpoznawane są u chorych z PChN. Występują one w różnych proporcjach zależnie od profilu czynników ryzyka i czasu ich oddziaływania.
Przerost i przebudowa lewej komory są najbardziej typowymi zjawiskami wśród chorych z PChN. Dokładny mechanizm nie jest jednak poznany. Przerost serca jest mechanizmem adaptacyjnym do zwiększonych obciążeń, a jego charakter ponownie zależy od profilu czynników ryzyka i czasu trwania ich oddziaływania. Dzięki przerostowi napięcie ścian ulega zmniejszeniu.