Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Kardiologia interdyscyplinarna
Klinika Kardiologii PUM, Szczecin
Powikłania kardiologiczne w twardzinie układowej
Michał Ciurzyński, Katarzyna Irzyk, Piotr Bienias
Wprowadzenie
Twardzina układowa (systemic sclerosis/scleroderma, SSc) należy do grupy chorób układowych tkanki łącznej (connective tissue disease, CTD). Etiologia sklerodermii jest nie do końca poznana. Możliwy jest udział czynników genetycznych, środowiskowych i autoimmunologicznych. W przebiegu SSc dochodzi do nieprawidłowej waskulo- i angiogenezy oraz nasilonego włóknienia skóry i narządów wewnętrznych. Prowadzi to do stopniowego upośledzenia funkcji narządów, a w skrajnych przypadkach do ich niewydolności. Istnieją dwa główne typy twardziny: postać ograniczona (limited scleroderma, lSSc) i uogólniona (diffuse scleroderma, dSSc). W typie pierwszym zajęcie skóry nie przekracza dystalnych części kończyn, a do zajęcia narządów wewnętrznych dochodzi w późniejszym okresie. W podtypie uogólnionym zajęta procesem może być skóra całego ciała, a choroba postępuje bardziej agresywnie.
SSc to rzadka choroba, występuje u ok. 0,02% populacji, częściej u osób rasy czarnej. Około 90% chorych z SSc to kobiety. Szczyt zachorowań przypada między 3 a 5 dekadą życia [1]. Szacuje się, że w Polsce na SSc choruje około 10 000 osób [2]. W przebiegu SSc procesem chorobowym mogą być objęte wszystkie narządy wewnętrzne, jednak do najgroźniejszych powikłań SSc należą: śródmiąższowa choroba płuc (intestinal lung disease, ILD), tętnicze nadciśnienie płucne (pulmonary arterial hypertension, PAH) oraz twardzinowy przełom nerkowy (scleroderma renal crisis, SRC). Obecnie, w dobie szerokiego stosowania inhibitorów konwertazy angiotensyny, SRC występuje znacznie rzadziej, a główną przyczyną śmiertelności w przebiegu SSc są ILD i PAH, będące przyczyną odpowiednio 33 i 27% zgonów [1]. Powikłania sercowe choroby są przyczyną około 15% zgonów [3]. Średnia 10-letnia przeżywalność chorych z SSc wynosi około 66% [1].
Zmiany w naczyniach u chorych z twardziną układową
W patogenezie SSc kluczową rolę odgrywa uszkodzenie naczyń krwionośnych, procesy immunologiczno-zapalne oraz włóknienie skóry i narządów wewnętrznych. Charakterystyczna dla sklerodermii jest nadmierna produkcja kolagenu, glikozaminoglikanów i fibronektyny przez fibroblasty. Już we wczesnym okresie choroby wokół naczyń krwionośnych skóry i narządów wewnętrznych stwierdza się nacieki zapalne składające się głównie z komórek jednojądrzastych. Jednym z pierwszych etapów uszkodzenia naczyń w przebiegu SSc jest dysfunkcja komórek śródbłonka. Upośledzenie czynności endotelium prowadzi do rozwoju zapalenia, aktywacji limfocytów B i T, nadmiernego wydzielania cytokin oraz chemokin, takich jak: IL-4, IL-13, białko chemotaktyczne 1 (MCP-1). Zwiększenie ekspresji cząsteczek adhezyjnych przez aktywowane komórki śródbłonka ułatwia migrację komórkom zapalnym, co przyczynia się do nasilenia procesu zapalnego. Uszkodzony śródbłonek nie syntetyzuje, a więc i nie uwalnia odpowiedniej ilości tlenku azotu, nie dochodzi więc do dostatecznej wazodylatacji. Wielu autorów, posługując się oceną reaktywności tętnic w odpowiedzi na przekrwienie (flow mediated dilatation, FMD), potwierdziło uszkodzenie śródbłonka i upośledzenie wazodylatacji dużych naczyń u pacjentów z SSc [4,5]. Inaczej niż w innych chorobach tkanki łącznej, takich jak reumatoidalne zapalenie stawów czy toczeń rumieniowaty układowy, w których obserwuje się przyspieszenie aterogenezy, u pacjentów z SSc zmiany w naczyniach dotyczą przede wszystkim mikrokrążenia. Mimo że dostępne w piśmiennictwie dane świadczą o przyspieszeniu prędkości fali tętna w tej grupie pacjentów (pulse wave velocity, PWV), co pośrednio przemawia za zwiększoną sztywnością ściany dużych naczyń tętniczych, to jednak bezpośrednich dowodów na przyspieszoną miażdżycę dotychczas nie uzyskano [6,7].
Nadciśnienie płucne
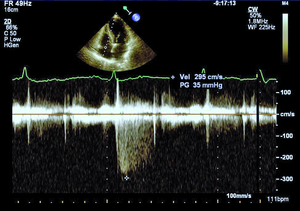
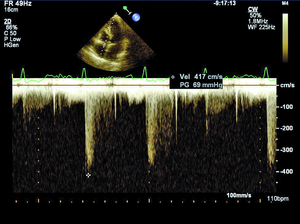
Rycina 1. Nieznacznie podwyższony gradient niedomykalności trójdzielnej (TRPG) 35 mm Hg mierzony w spoczynku u chorej z SSc.
Według najnowszych zaleceń Europejskiego Towarzystwa Kardiologicznego nadciśnienie płucne (pulmonary hypertension, PH) rozpoznajemy, gdy średnie ciśnienie w tętnicy płucnej (mPAP) w spoczynku oznaczane w pomiarze bezpośrednim podczas cewnikowania prawego serca (right heart catetherization, RHC) wynosi ≥25 mm Hg (przy normie do 20 mm Hg) [8]. W zależności od zastosowanych metod diagnostycznych, kryteriów rozpoznania oraz badanej populacji PH rozpoznaje się u 5-50% chorych z SSc [9]. Tętnicze nadciśnienie płucne występuje zwykle u chorych z lSSc i jest stwierdzane u ok. 7-12% pacjentów [8]. Śródmiąższowa choroba płuc obserwowana jest częściej w dSSc i jest przyczyną PH wtórnego do zajęcia płuc i hipoksemii [10]. W przebiegu sklerodermii może również rozwinąć się żylne PH oraz sporadycznie przewlekłe zakrzepowo-zatorowe nadciśnienie płucne (chronic thromboembolic pulmonary hypertension, CTEPH) [8,11]. W przypadku podejrzenia PH wymagana jest szybka i precyzyjna diagnostyka, ponieważ wczesne postawienie właściwego rozpoznania pozwala na włączenie celowanego leczenia poprawiającego rokowanie w tej grupie chorych. Podczas diagnostyki PH koniecznie należy również ustalić, jaki mechanizm jest odpowiedzialny za jego rozwój, ponieważ to determinuje dalsze postępowanie. Echokardiografia przezklatkowa jako metoda nieinwazyjna i łatwo dostępna jest badaniem przesiewowym w diagnostyce PH, a także służy do monitorowania postępu choroby u pacjentów z już rozpoznanym nadciśnieniem płucnym. Według wytycznych europejskich zalecane jest wykonywanie badania echokardiograficznego raz w roku u objawowych pacjentów z SSc (klasa zaleceń I, poziom dowodów A) oraz rozważenie wykonania takiego badania u chorych bez objawów (IIb/C) [8]. Podejrzenie PH w ocenie echokardiograficznej wysuwa się, gdy skurczowe ciśnienie w tętnicy płucnej (right ventricular systolic pressure, RVSP) wynosi >36 mm Hg, co odpowiada prędkości fali niedomykalności trójdzielnej >2,8 m/s lub gdy stwierdza się inne odchylenia echokardiograficzne, wskazujące na PH przy prawidłowym RVSP [8]. Należy jednak pamiętać, że echokardiografia w diagnostyce PH wciąż pozostaje metodą przesiewową, a złotym standardem nadal jest RHC [8]. W ostatnich latach za pomocą echokardiografii wykazano, że u chorych z SSc dochodzi do nadmiernego wzrostu ciśnienia w tętnicy płucnej podczas wysiłku (ryc. 1, 2) [12]. U zdrowych osób ciśnienie w tętnicy płucnej podczas wysiłku fizycznego pozostaje niezmienione lub wzrasta tylko nieznacznie. Znaczenie tego zjawiska nie zostało w pełni poznane. Można podejrzewać, że u pacjentów z SSc i prawidłowym spoczynkowym ciśnieniem w tętnicy płucnej indukowany wysiłkiem fizycznym nadmierny wzrost ciśnienia w tętnicy płucnej jest wczesnym objawem waskulopatii tętniczek płucnych. Możliwe, że chorzy ci są w przedklinicznym stadium PAH związanego z SSc i mogliby w przyszłości skorzystać z wcześniejszego włączenia leczenia celowanego na tętniczki płucne. Innym potencjalnym mechanizmem rozwoju spoczynkowego PH lub nieprawidłowego wzrostu ciśnienia w tętnicy płucnej podczas wysiłku jest dysfunkcja rozkurczowa lewej komory (left ventricle, LV). Postępujące włóknienie mięśnia serca powoduje upośledzenie relaksacji LV, co w warunkach obciążenia wysiłkiem powoduje nadmierny wzrost pozawłośniczkowego ciśnienia w tętnicy płucnej. Ta interesująca hipoteza jest poparta coraz większą liczbą badań prowadzonych w ostatnich latach [11,13]. W badaniach własnych w grupie 85 pacjentów z SSc autorzy wykazali nadmierny wysiłkowy wzrost pozawłośniczkowego ciśnienia w tętnicy płucnej u 15 (75%) z 20 chorych poddanych spoczynkowemu i wysiłkowemu RHC. Identyfikacja grupy chorych z SSc i nieprawidłowym wzrostem ciśnienia w tętnicy płucnej o etiologii żylnej jest bardzo ważna ze względu na potencjalne wczesne możliwości terapeutyczne w tej grupie pacjentów. Niewątpliwie zagadnienie nadmiernego wzrostu ciśnienia w tętnicy płucnej podczas wysiłku, jego etiologii oraz roli echokardiografii wysiłkowej w diagnostyce PH wymaga dalszych badań.
Zaburzenia czynności skurczowej i rozkurczowej mięśnia serca
Funkcja skurczowa lewej i prawej komory serca
Dostępne piśmiennictwo dostarcza sprzecznych danych na temat częstości i nasilenia dysfunkcji skurczowej lewej komory serca. Istotna dysfunkcja skurczowa LV, wyrażająca się obniżeniem frakcji wyrzutowej (EF) oraz objawami zastoinowej niewydolności serca, występuje u mniej niż 5% chorych, głównie z dSSc [14,15]. De Groote i wsp. w grupie 570 chorych z SSc wykazali upośledzenie funkcji skurczowej LV tylko u 1,4% z nich [16]. Inni badacze stwierdzili dysfunkcję skurczową LV (EF <55%) u 383 (5,4%) z 7073 chorych z SSc [17]. Dopiero wprowadzenie dokładniejszych technik obrazowania (echokardiograficzna technika doplera tkankowego [TDE] oraz ocena mięśnia serca w rezonansie magnetycznym [MR]) umożliwiło uwidocznienie subklinicznych zaburzeń kurczliwości mięśnia serca. Meune i wsp. stwierdzili upośledzenie funkcji skurczowej LV ocenianej za pomocą TDE u 14 ze 100 chorych ze sklerodermią [18]. Podczas analizy morfologii i funkcji serca za pomocą MR w grupie 52 pacjentów z SSc Hachulla i wsp. wykazali upośledzenie kurczliwości LV u 12 (23%) pacjentów (średnia EF 48±4%), a u 16 (31%) stwierdzono odcinkowe zaburzenia kurczliwości LV pod postacią hipokinezy [19]. W pojedynczych doniesieniach wykazano także upośledzenie funkcji skurczowej prawej komory (right ventricle, RV) serca u chorych z SSc [20,21]. W cytowanej już wcześniej pracy Meune i wsp., oceniając 100 chorych z SSc za pomocą techniki TDE, wykazali upośledzenie funkcji skurczowej RV u 15 osób w grupie badanej i u żadnego z grupy kontrolnej (p=0,039) [18].
Funkcja rozkurczowa lewej i prawej komory serca
Dysfunkcja rozkurczowa LV u chorych z SSc jest zazwyczaj wynikiem pierwotnego włóknienia miokardium i jest stwierdzana u ok. 20-60 % chorych z SSc [3]. Echokardiografia jest obecnie najbardziej dostępną metodą oceny funkcji rozkurczowej komór serca o dobrze udokumentowanej przydatności. W wielu pracach za pomocą analizy doplerowskiego napływu mitralnego oceniano funkcję rozkurczową LV u pacjentów z SSc. Kazzam i wsp. stwierdzili upośledzenie funkcji rozkurczowej u 17 (60%) z 28 chorych z SSc [22]. W innej pracy Maione i wsp. wykazali zaburzenia rozkurczu u 9 (18%) z 51 badanych z SSc [23]. Meune i wsp. przy użyciu techniki TDE stwierdzili upośledzenie funkcji rozkurczowej u 30 ze 100 chorych z SSc [18]. W polskim piśmiennictwie funkcję rozkurczową LV analizowali Wranicz i wsp. Wykazali jej upośledzenie u 6 (27%) z 22 pacjentów z SSc [24], natomiast autorzy obecnego opracowania stwierdzili upośledzenie relaksacji LV u 28 (55%) pacjentów z SSc i u 8 (26%) z grupy kontrolnej (p <0,001) [25]. Ocena funkcji rozkurczowej RV jest znacznie trudniejsza ze względu na ograniczenia metodyczne. Nie jest do końca ustalone także kliniczne i prognostyczne znaczenie jej upośledzenia. Dostępnych jest niewiele prac oceniających funkcję rozkurczową RV u chorych z SSc. Giunta i wsp. wykazali upośledzenie funkcji rozkurczowej RV u 31 (40%) z 77 chorych z SSc i u żadnego z grupy kontrolnej [26], natomiast autorzy tego artykułu stwierdzili zaburzenia relaksacji RV u 16 (31%) pacjentów z SSc i u 5 (16%) z grupy kontrolnej (p <0,001) [25].
Choroba wieńcowa
W większości badań wykazano, że częstość występowania choroby wieńcowej u pacjentów z SSc jest zbliżona do tej w populacji ogólnej i wynosi 15-22% [27,28]. Objawy prezentowane przez chorych mogą być niespecyficzne i nierzadko trudne do zróżnicowania ze względu na często współtowarzyszące PH lub ILD [29]. U chorych bez objawów niekiedy również stwierdza się zmiany w tętnicach wieńcowych. Tarek i wsp. wykonali koronarografię u 5 bezobjawowych chorych z lSSc i 9 z dSSc i wykryli istotne zwężenia w tętnicach wieńcowych u 3 pacjentów z lSSc [30]. Inni autorzy ocenili retrospektywnie 1009 chorych z SSc hospitalizowanych w latach 1982-2002. W badanej populacji zawał mięśnia sercowego wystąpił u 11 (1,09%) chorych, przy czym u 3 z nich nie stwierdzono istotnych zwężeń w tętnicach wieńcowych [31]. Brakuje jednoznacznych danych potwierdzających przyspieszoną aterogenezę w przebiegu SSc, jednak subkliniczną miażdżycę tętnic wieńcowych stwierdza się u chorych z SSc częściej niż w ogólnej populacji, a sklerodermia uznawana jest za niezależny czynnik ryzyka wystąpienia zwapnień w łożysku wieńcowym. Mok i wsp. za pomocą tomografii komputerowej ocenili naczynia wieńcowe u 53 chorych z SSc. Autorzy na podstawie analizy wieloczynnikowej stwierdzili, że SSc jest niezależnym czynnikiem ryzyka wystąpienia istotnych zwapnień w tętnicach wieńcowych (calcium score >101) (iloraz szans [OR] 10,89, 95% przedział ufności [CI] 2,21-53,75, p=0,003) [32]. W jednym z ostatnich badań z udziałem 850 pacjentów z SSc Ngain i wsp. wykazali, że ryzyko wystąpienia choroby wieńcowej jest u nich większe niż u osób z grupy kontrolnej (OR 2,0, 95% CI 1,5-2,5) [33]. Jest to pierwsze doniesienie sugerujące częstsze występowanie choroby wieńcowej u pacjentów z SSc niż w populacji ogólnej. Udowodniono także, że u chorych ze sklerodermią znacznie upośledzona jest również rezerwa wieńcowa [34]. Nie należy zapominać, że objawy choroby wieńcowej u tych pacjentów mogą wynikać z upośledzenia mikrokrążenia. W badaniach pośmiertnych 52 chorych z SSc Bulkley i wsp. stwierdzili, że martwica mięśnia sercowego może być spowodowana przejściowym skurczem małych naczyń (tzw. miokardialny objaw Raynaud) [35]. Niewątpliwie zagadnienie rozwoju miażdżycy u chorych z SSc wymaga dalszych badań.
Wysięk osierdziowy
Przy zastosowaniu obrazowych metod diagnostycznych wysięk osierdziowy, najczęściej niewielki, stwierdza się u 10-40% chorych z SSc [15]. Przyczyną gromadzenia się płynu w jamie osierdzia jest immunologicznie uwarunkowany proces zapalny. Zajęcie osierdzia zwykle nie daje objawów, ale mogą one wystąpić u 7-20% pacjentów. Maione i wsp. w badaniach echokardiograficznych wykazali wysięk osierdziowy u 33 (45%) z 77 pacjentów z SSc. Tylko u 18 (14%) z nich był to wysięk istotny klinicznie [36].
Zapalenie mięśnia serca
Zapalenie mięśnia serca jest rzadkim powikłaniem SSc, ale stosunkowo często towarzyszy zapaleniu mięśni szkieletowych. Follansbee i wsp. opisali grupę 1095 chorych z SSc. U 183 (17%) z nich doszło do rozwoju zapalenia mięśni szkieletowych, które u 39 (21%) współwystępowało z zapaleniem mięśnia sercowego. W tej grupie 18 (72%) chorych zmarło, z czego aż 62% w mechanizmie nagłego zgonu sercowego [37]. Kerr i wsp. opisali 6 chorych z SSc i zapaleniem mięśni szkieletowych (myositis), u których doszło do zapalenia mięśnia serca powikłanego ciężką niewydolnością serca [38]. W obu pracach wykazano, że wystąpienie zapalenia mięśnia serca wiąże się z niekorzystnym rokowaniem.