Echokardiografia w diagnostyce zespołu wątrobowo-płucnego
lek. Małgorzata Kowalczyk
prof. dr hab. n. med. Mirosław Kowalski
- Co trzeba wiedzieć na temat zespołu wątrobowo-płucnego
- Kryteria diagnostyczne i rola echokardiografii w rozpoznawaniu tego schorzenia
- Opis przypadku z praktyki klinicznej
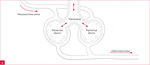
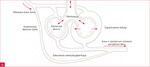
Zespół wątrobowo-płucny (HPS – hepatopulmonary syndrome) jest powikłaniem zaawansowanych chorób wątroby przebiegających z nadciśnieniem wrotnym. Polega na zmniejszeniu utlenowania krwi tętniczej w wyniku przecieku wewnątrzpłucnego1. Szacuje się, że występuje u ok. 4-19% pacjentów z marskością wątroby2. Charakterystycznymi cechami HPS są zmniejszenie oporu tętniczek płucnych oraz tworzenie pozapęcherzykowych anastomoz tętniczo-żylnych, co powoduje dysproporcję między przepływem krwi a wentylacją pęcherzykową (ryc. 1)1.
Rycina 1A, B. Mechanizmy prowadzące do hipoksji w zespole wątrobowo-płucnym. A. Prawidłowe krążenie płucne. B. Zespół wątrobowo-płucny
Kluczowym elementem patofizjologii HPS jest przeciek wewnątrzpłucny spowodowany spadkiem oporu kapilar płucnych. Nadmierne poszerzenie tętniczek płucnych wynika najprawdopodobniej z zaburzeń produkcji czynników wazoreaktywnych przez marską wątrobę, która uwalnia zwiększone ilości endoteliny 1. Dodatkowymi czynnikami są nadekspresja receptorów B dla endoteliny 1 w śródbłonku naczyniowym płuc oraz akumulacja makrofagów płucnych3. Badania mieszaniny oddechowej pacjentów z HPS wykazały zwiększony udział tlenku azotu w mieszaninie wydechowej, co pośrednio potwierdza rolę tej substancji jako mediatora obserwowanych zmian naczyniowych4. Spadek oporu drobnych naczyń płucnych umożliwia przepływ mieszanej krwi żylnej do żył płucnych, a następnie do krążenia systemowego.
W tkance płucnej pacjentów z HPS obserwuje się nadmiar czynników pobudzających angiogenezę, które stymulują powstawanie kolaterali tętniczo-żylnych, pogłębiających hipoksję (ryc. 1). Co więcej, u chorych z marskością wątroby dochodzi do osłabienia lub zaniku odruchu wazokonstrykcji w odpowiedzi na hipoksemię5. Brak regulacji przepływu skutkuje nadmierną perfuzją niedostatecznie wentylowanych obszarów płuc.
Obraz kliniczny
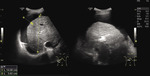
Rycina 2. Ultrasonografia jamy brzusznej pacjentki z marskością wątroby: widoczny płyn w jamie otrzewnej i nierówny brzeg wątroby
Objawy zgłaszane przez pacjentów z HPS wynikają zarówno z choroby wątroby, jak i desaturacji krwi tętniczej (ryc. 2). Są to głównie: osłabienie, upośledzona tolerancja wysiłku, dolegliwości bólowe brzucha, utrata łaknienia, drżenia rąk.
W badaniu fizykalnym zwracają uwagę cechy wodobrzusza, obrzęki obwodowe, żółtaczka, teleangiektazje. W zaawansowanym stadium obserwuje się sinicę centralną i palce pałeczkowate.
Charakterystycznymi objawami HPS są: platypnea (duszność nasilająca się w pozycji stojącej, zmniejszająca się po przyjęciu pozycji leżącej) oraz ortodeoksja (spadek ciśnienia parcjalnego tlenu w krwi tętniczej o co najmniej 4 mmHg po pionizacji).
Do rozpoznania HPS konieczne jest spełnienie następujących kryteriów:
1. Obniżone ciśnienie parcjalne tlenu w krwi tętniczej (PaO2 <80 mmHg) i/lub gradient pęcherzykowo-włośniczkowy ≥15 mmHg.
Gradient pęcherzykowo-włośniczkowy (PAO2 – PaO2) oblicza się z następującego wzoru:
PAO2 – PaO2 = [Patm – 47 – (PaCO2 + PaO2)] / FiO2