Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Zaburzenia rytmu i przewodzenia
Amiodaron – skuteczniejsze i bezpieczniejsze leczenie przewlekłe
Maria Trusz-Gluza
Wprowadzenie
Amiodaron, uważany za najsilniejszy lek antyarytmiczny, został wprowadzony do leczenia w latach 60. XX wieku jako tzw. lek wieńcowy. Dopiero w latach 70. w Argentynie zaczęto go po raz pierwszy stosować w opornych zaburzeniach rytmu serca. W 1986 r. amiodaron uzyskał akceptację FDA do zastosowania w opornych, zagrażających życiu arytmiach komorowych, natomiast nie został zarejestrowany w leczeniu migotania przedsionków.
Właściwości elektrofizjologiczne
Amiodaron jest jodową pochodną benzofuranu. Lek wykazuje złożone działanie elektrofizjologiczne. Co prawda zalicza się go do klasy III leków antyarytmicznych, ale posiada także właściwości charakteryzujące leki klasy I, II i IV [1-3]. Głównym działaniem jest hamujący wpływ na kanały potasowe, co wydłuża czas trwania potencjału czynnościowego, a w konsekwencji czas refrakcji we wszystkich rodzajach komórek mięśnia sercowego – węzła zatokowego, przedsionków, węzła przedsionkowo-komorowego (AV) i komór (mniej włókien Purkinjego). Wydłużenie repolaryzacji i refrakcji jest jednorodne (zmniejsza się dyspersja repolaryzacji), większe przy wyższej częstości akcji serca (use-dependent effect), a ujawnia się dopiero po nasyceniu chorego amiodaronem.
Dodatkowo, hamując kanały sodowe w słabym lub umiarkowanym stopniu (efekt klasy I), zwalnia przewodzenie, a przez niekompetytywne blokowanie receptorów beta-adrenergicznych (efekt klasy II) zwalnia częstość rytmu zatokowego. Osłabia też czynność dokomórkowych kanałów wapniowych typu L (efekt klasy IV) [1-3]. Działanie antyarytmiczne amiodaronu jest również związane z hamowaniem dejodynacji tyroksyny (T4) do trójjodotyroniny (T3). W porównaniu z innymi lekami antyarytmicznymi rzadko wykazuje działanie proarytmiczne. Stosowany doustnie nie działa kardiodepresyjnie.
Farmakokinetyka
Amiodaron ma również bardzo złożone właściwości farmakokinetyczne [1-3]. Biodostępność waha się od 22 do 86% i średnio wynosi 50%. Lek jest silnie lipofilny i ma dużą objętość dystrybucji (66 l/kg), co skutkuje opóźnieniem działania przy stosowaniu doustnym (3-10 dni) oraz bardzo długim okresem półtrwania w fazie eliminacji, aż wyczerpią się zapasy tkankowe. Efekt pierwszego przejścia przez wątrobę jest niewielki. Amiodaron jest przekształcany w wątrobie przez enzymy cytochromu P450 do desetyloamiodaronu i wydalany z żółcią. Metabolit wykazuje właściwości elektrofizjologiczne podobne do substancji macierzystej i jeszcze dłuższy okres eliminacji. Jedynie mniej niż 1% leku wydzielane jest z moczem w postaci niezmienionej. Stężenie amiodaronu i jego metabolitu w surowicy nie koreluje dobrze ze skutecznością ani z objawami niepożądanymi. Lek odkłada się w tkankach – wątrobie, płucach, skórze, tkance tłuszczowej i w sercu, gdzie jego stężenie jest 10-50 razy większe niż w surowicy. Lek w dużym odsetku (ok. 95%) wiąże się z białkami krwi. Przechodzi przez łożysko i do mleka matki. Okres półtrwania w fazie eliminacji amiodaronu wynosi od 2 tygodni do 3 miesięcy – najczęściej 40-60 dni. Usuwanie leku z ustroju przebiega dwufazowo. W pierwszym etapie następuje eliminacja z tkanek o dużym przepływie krwi – wówczas w ciągu 2-10 dni stężenie amiodaronu zmniejsza się o połowę. Dalsza eliminacja przebiega znacznie wolniej (26-107 dni), co jest związane z uwalnianiem amiodaronu ze słabo ukrwionych tkanek, takich jak tkanka tłuszczowa. Istnieją bardzo duże indywidualne różnice w właściwościach farmakokinetycznywch.
Skuteczność i wskazania
Nadkomorowe zaburzenia rytmu
W arytmiach nadkomorowych amiodaron najczęściej stosowany jest u chorych z migotaniem przedsionków (AF). Skuteczność leku w AF przebadano w dużych randomizowanych badaniach prospektywnych (tab. 1), a także w metaanalizach [4-7]. Metaanaliza przeprowadzona przez Freemantle’a i wsp. wykazała, że amiodaron jest najskuteczniejszym lekiem antyarytmicznym w zapobieganiu nawrotom AF (iloraz szans [OR] 0,22, 95% przedział ufności [PU] 0,16-0,29), jednak ryzyko wystąpienia poważnych zdarzeń niepożądanych u leczonych osób było największe (OR 2,41, 95% PU 0,96-6,06), podobnie jak konieczność odstawienia leku z powodu tych zdarzeń (OR 2,91, 95% PU 1,66-5,11) [8]. W porównaniu z innymi lekami antyarytmicznymi amiodaron wykazuje mniejsze działanie proarytmiczne. Stwierdzono jednak tendencję do zwiększania ryzyka zgonu (OR 2,17, 95% PU 0,63-7,51). Należy podkreślić, że w wielu badaniach ocena leku obejmowała stosunkowo krótki, bo roczny okres obserwacji. Nie dysponujemy wynikami długoterminowych badań.
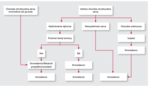
Wskazania do stosowania amiodaronu w leczeniu AF zostały uporządkowane w wytycznych Europejskiego Towarzystwa Kardiologicznego (ESC) poświęconych tej arytmii [9,10]. Wybór strategii walki o utrzymanie rytmu zatokowego jest zalecany praktycznie tylko u pacjentów objawowych. U osób bez choroby strukturalnej serca (lub z chorobą o niewielkim nasileniu), z nadciśnieniem tętniczym (z przerostem lewej komory lub bez niego) lub z chorobą niedokrwienną serca amiodaron jest lekiem ostatniego wyboru, gdy inne zalecane leki są nieskuteczne lub nietolerowane (rycina). Natomiast u chorych z niewydolnością serca amiodaron jest lekiem podstawowym. W bieżącym rejestrze europejskim poświęconym stosowaniu leków antyarytmicznych w AF stwierdzono, że amiodaronu prawie w ogóle nie stosowano u pacjentów bez choroby strukturalnej serca, w 24% u chorych z nadciśnieniem tętniczym z przerostem, w 19% w chorobie niedokrwiennej serca bez dysfunkcji lewej komory i w 73% w niewydolności serca z objawami odpowiadającymi klasie III i IV według NYHA [11].
U chorych z utrwalonym AF zgodnie z wytycznymi można rozważyć (klasa zaleceń IIb, poziom dowodów C) zastosowanie amiodaronu do kontroli częstotliwości rytmu komór, gdy inne leki są nieskuteczne lub przeciwwskazane [9]. Sądzę jednak, że można sięgać po amiodaron w takich sytuacjach jedynie wyjątkowo.
W przypadku trzepotania przedsionków skuteczność leków antyarytmicznych, także amiodaronu, w leczeniu przewlekłym jest mała, mniejsza niż w AF. Tymczasem skuteczność ablacji jest bardzo duża (>90%) i tę metodę leczenia należy pacjentom proponować [1-3].
Podobnie wygląda sytuacja w różnych napadowych częstoskurczach nadkomorowych, w tym w zaburzeniach rytmu serca w przebiegu zespołu Wolffa-Parkinsona-White’a. We wszystkich tych arytmiach skuteczność ablacji jest znacznie większa niż leków, a w wielu przypadkach daje ona trwałe wyleczenie. Amiodaron stosuje się u tych chorych wyjątkowo, gdy inne leki są nieskuteczne, źle tolerowane, a chory nie wyraża zgody na ablację [1-3]. Należy pamiętać, że amiodaron jest lekiem niekorzystnym w tzw. leczeniu pomostowym, gdy pacjent oczekuje na termin ablacji lub jeszcze nie podjął decyzji. Głównym powodem jest bardzo długi i nieprzewidywalny czas eliminacji amiodaronu, co może utrudnić wykonanie skutecznej ablacji.
Komorowe zaburzenia rytmu
Najważniejszym badaniem klinicznym oceniającym wpływ amiodaronu na ryzyko nagłego zgonu sercowego (sudden cardiac death, SCD) jest badanie SCD-HeFT, w którym u pacjentów z niewydolnością serca w klasie II lub III wg NYHA porównywano działanie kardiowertera-defibrylatora (ICD), amiodaronu i placebo [12]. Wykazano, że amiodaron w odróżnieniu od ICD nie zmniejszał całkowitej śmiertelności w tej populacji. Dodatkowo, okazało się, że w subpopulacji pacjentów w III klasie wg NYHA śmiertelność ogólna, w tym z przyczyn pozasercowych wzrastała. Tymczasem metaanaliza 15 badań, do których włączono 8552 pacjentów leczonych amiodaronem lub placebo, wykazała, że lek zmniejszał ryzyko SCD (OR 0,71, 95% PU 0,61-0,84) i śmiertelność z przyczyn sercowo-naczyniowych (OR 0,82, 95% PU 0,71-0,94) bez istotnego wpływu na ogólną śmiertelność [13]. Słuszne wydaje się więc zalecenie zawarte w wytycznych ESC poświęconych niewydolności serca, że zastosowanie amiodaronu można rozważyć (klasa zaleceń IIb, poziom dowodów C) u pacjentów niebędących kandydatami do ICD lub niewyrażających zgody na implantację urządzenia [14]. Amiodaron można na przykład rozważyć, oprócz ablacji, u chorego z epizodami utrwalonego częstoskurczu komorowego (sustained ventricular tachycardia, sVT) stabilnego hemodynamicznie, gdy LVEF wynosi >35-40% [14,15]. Nie zaleca się natomiast rutynowego stosowania amiodaronu u chorych z nieutrwalonym częstoskurczem komorowym (nsVT), ponieważ brakuje dowodów na korzyści, przy ewidentnej toksyczności leku.
Amiodaron zaleca się (klasa I) chorym z wszczepionym ICD, u których dochodzi do nawrotów VT, zwłaszcza gdy epizody te wymagają interwencji ICD elektrowstrząsami mimo optymalnego zaprogramowania urządzenia [15]. Na słuszność takiego postępowania wskazują wyniki badania OPTIC, w którym u 412 pacjentów z ICD porównywano skuteczność leku beta-adrenolitycznego, połączenia amiodaronu i beta-adrenolityku oraz sotalolu [16]. Najskuteczniejsze było połączenie amiodaronu z beta-adrenolitykiem (iloraz zagrożeń [HR] 0,27, 95% PU 0,14-0,52) i z takiego leczenia skojarzonego należy korzystać, zwłaszcza u chorych z burzą elektryczną. Oczywiście u chorych z ICD i nawracającymi interwencjami należy także rozważać ablację. W fazie rozszerzonej badania OPTIC potwierdzono, że amiodaron podwyższa próg defibrylacji. Jest to jednak wpływ nieduży i przy nowej generacji ICD nie powinien mieć znaczenia praktycznego [17].
Dodatkowe wskazania do amiodaronu mają chorzy: